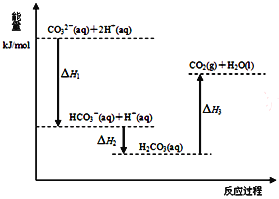
题目内容
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列分析不正确的是

A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同物质的量的OH-
【答案】D
【解析】
分析特殊点,a点为硫酸和氢氧化钡恰好反应的点,导电性几乎为零,b点为氢氧化钡和硫酸氢钠反应时钡离子恰好沉淀的点,d点为氢氧化钡和硫酸氢钠反应时恰好中和的点。
A. 根据图知,曲线①在a点溶液导电能力接近0,说明该点溶液离子浓度最小,应该为![]() 溶液和硫酸的反应,则曲线②为
溶液和硫酸的反应,则曲线②为![]() 溶液和硫酸氢钠溶液的反应,故A正确;
溶液和硫酸氢钠溶液的反应,故A正确;
B.根据图知,a点为![]() 溶液和硫酸恰好反应,硫酸和硫酸氢钠溶液的物质的量浓度相等,则b点为钡离子恰好沉淀,溶质为氢氧化钠,B正确;
溶液和硫酸恰好反应,硫酸和硫酸氢钠溶液的物质的量浓度相等,则b点为钡离子恰好沉淀,溶质为氢氧化钠,B正确;
C. a点为![]() 溶液和硫酸恰好反应,显中性,d点为氢氧化钡和硫酸氢钠反应时恰好中和的点,溶液显中性,C正确;
溶液和硫酸恰好反应,显中性,d点为氢氧化钡和硫酸氢钠反应时恰好中和的点,溶液显中性,C正确;
D.c点加入硫酸和硫酸氢钠的物质的量相等,故加入氢离子的量不相等,故氢氧根的量不相等,D错误;
答案选D。

【题目】已知:H2(g)+I2(g) ![]() 2HI(g) H=-149kJ/mol。在甲、乙两个体积相同的密闭容器中充入反应物,保持恒温恒容,其起始浓度如下表所示。
2HI(g) H=-149kJ/mol。在甲、乙两个体积相同的密闭容器中充入反应物,保持恒温恒容,其起始浓度如下表所示。
起始 浓度 | c(H2)(mol/L) | c(I2)(mol/L) | c(HI)/(mol/L) |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
甲中反应达到平衡时,测得c(H2)=0.008 mol/L下列判断正确的是( )
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25
【题目】800°C时,在2L密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g) H<0,测得n(NO)随时间的变化如下表:
2NO2(g) H<0,测得n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)NO的平衡浓度c(NO)=____________________。
(2)下图中表示NO2的变化的曲线______________。(填字母)
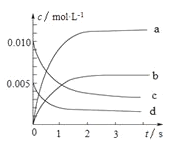
(3)能说明该反应已经达到化学平衡状态的是______________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=v正(O2) D.容器内NO、O2、NO2同时存在
(4)下列操作中,能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
A.及时分离出NO2气体B.适当升高温度
C.增大O2的浓度D.选择高效的催化剂
(5)下图中的曲线表示的是其它条件一定时,体系中NO的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示v(正)<v(逆)的点是____________。(填选项)
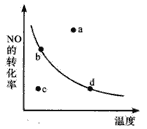
A.a B.b C.c D.d