题目内容
9.K2Fe04是一种既能杀菌消毒,豕能聚凝净水的水处理剂,工业上制备该物质的反应为:Fe(OH)3+C1O-+OH-→FeO42-+Cl-+H20 (未配平),则下列有关说法正确的是( )| A. | 该物质作净水处理剂与Cl2的作用原理完全相同 | |
| B. | 该反应表明碱性条件下ClO-氧化性强于FeO42- | |
| C. | 上述反应中Fe(0H)3与ClO-的物质的量之比应为3:2 | |
| D. | 因为FeO32-可直接水解生成氢氧化铁胶体,故可做自来水的聚凝剂 |
分析 Fe(OH)3+ClO-+OH-→FeO42-+Cl-+H2O中,Fe元素的化合价由+3价升高为+6价,Cl元素的化合价由+1价降低为-1价,由电子守恒和原子守恒可知,该反应为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,以此来解答.
解答 解:由电子守恒和原子守恒可知,该反应为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
A.K2FeO4处理水时,+6价铁为最高价,具有强氧化性能消毒杀菌,而且还原产生的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质,而氯气只能杀菌消毒,所以原理不完全相同,故A错误;
B.由反应可知,氧化剂的氧化性强于氧化产物,所以碱性条件下ClO-氧化性强于FeO42-,故B正确;
C.Cl元素的化化合价降低,Fe元素的化合价升高,则由反应可知还原剂Fe(0H)3和氧化剂ClO-的物质的量之比为2:3,故C错误;
D.K2FeO4处理水时,+6价铁为最高价,具有强氧化性能消毒杀菌,而且还原产生的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质,不可直接水解生成氢氧化铁胶体,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及电子守恒、原子守恒的综合考查,题目难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
19.化学在生产和生活中有重要的应用.下列说法正确的是( )
| A. | 房屋装修所用装饰材料释放出的甲醛、苯、氨等气体对人体无害,不会造成污染 | |
| B. | 食品包装袋小包内盛有装氧化钙或生石灰用作食品的抗氧化剂 | |
| C. | 制作航天服的聚酯纤维和“天宫一号”中使用的碳纤维都是新型无机非金属材料 | |
| D. | 绿色化学的核心就是利用化学原理从源头减少和消除工业对环境的污染 |
20.某学生将氯乙烷与NaOH溶液共热几分钟后,冷却,滴入AgNO3溶液,结果未见到有白色沉淀生成,其主要原因是 ( )
| A. | 加热时间太短 | B. | 不应冷却后再加入AgNO3溶液 | ||
| C. | 加AgNO3溶液前未用稀硝酸酸化 | D. | 反应后的溶液中不存在Cl- |
17.下列气体中,室温下能大量共存的是( )
| A. | NH3、CO2、HCl | B. | H2、Cl2、H2S | C. | NH3、O2、H2 | D. | CO2、H2S、SO2 |
6.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.假设常温下在恒容的密闭容器中发生上述反应,试解答下列问题:
(1)上述条件下该反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)能判断该反应达到化学平衡状态的依据是AB.
A.混合气体的压强保持不变
B.N2的浓度不再改变
C.消耗CO的物质的量与生成CO2的物质的量之比为1:1
D.NO、CO、CO2、N2的物质的量之比为2:2:2:1
(3)既要加快反应速率又要提高NO转化率,下列措施可行的是D.
A.选用更有效的催化剂B.升高反应体系的温度C.降低反应体系的温度D.缩小容器的体积
(4)为了测定在某种催化剂作用下的反应速率,某科学家在某温度下用气体传感器测得不同时间的NO和CO浓度如表(均不考虑温度变化对催化剂催化效率的影响):
从表中数据分析可知:
①c=2.70×10-3mol•L-1;
②前2s内的平均反应速率v(N2)=1.875×10-4mol/(L.s);
③该温度下反应的平衡常数K=5×103.
(1)上述条件下该反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)能判断该反应达到化学平衡状态的依据是AB.
A.混合气体的压强保持不变
B.N2的浓度不再改变
C.消耗CO的物质的量与生成CO2的物质的量之比为1:1
D.NO、CO、CO2、N2的物质的量之比为2:2:2:1
(3)既要加快反应速率又要提高NO转化率,下列措施可行的是D.
A.选用更有效的催化剂B.升高反应体系的温度C.降低反应体系的温度D.缩小容器的体积
(4)为了测定在某种催化剂作用下的反应速率,某科学家在某温度下用气体传感器测得不同时间的NO和CO浓度如表(均不考虑温度变化对催化剂催化效率的影响):
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)( mol•L-1) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)( mol•L-1) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | c | 2.70×10-3 |
①c=2.70×10-3mol•L-1;
②前2s内的平均反应速率v(N2)=1.875×10-4mol/(L.s);
③该温度下反应的平衡常数K=5×103.
4.由乙烯推测丙烯与溴水反应时,对反应产物的叙述正确的是( )
| A. | CH2Br-CH2-CH2Br | B. | CH3-CHBr-CH3 | C. | CH3-CH2-CHBr2 | D. | CH3-CHBr-CH2Br |

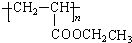 .
. .
. 与
与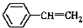 也可以发生类似反应①的反应,其有机产物的结构简式为:
也可以发生类似反应①的反应,其有机产物的结构简式为: .
.