题目内容
6.根据SO2通入不同溶液中实验现象,所得结论不正确的是( )| 实验 | 现象 | 结论 | |
| A | 含HCl、BaCl2的FeCl3溶液 | 产生白色沉淀 | SO2有还原性 |
| B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 |
| C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 |
| D | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.铁离子能够将二氧化硫氧化成硫酸,生成的白色沉淀为硫酸钡,二氧化硫被氧化;
B.黄色沉淀为S单质,结合化合价变化分析;
C.酸性高锰酸钾溶液具有强氧化性,能够氧化二氧化硫;
D.生成的胶状沉淀为H2SiO3,根据强酸制取弱酸原理分析.
解答 解:A.FeCl3将SO2氧化成硫酸根离子,硫酸根离子与BaCl2反应生成硫酸钡沉淀,该反应中二氧化硫被氧化,表现了还原性,故A正确;
B.SO2与H2S反应生成S单质,该反应中SO2中+4价S元素被还原生成0价的单质S,二氧化硫被还原,做氧化剂,故B正确;
C.酸性KMnO4溶液能够氧化SO2,导致溶液褪色,SO2表现了还原性,故C错误;
D.Na2SiO3溶液中通入二氧化硫生成H2SiO3,说明亚硫酸的酸性较强,即酸性:H2SO3>H2SiO3,故D正确;
故选C.
点评 本题考查二氧化硫的性质,题目难度中等,明确常见元素及其化合物性质为解答关键,注意掌握二氧化硫的化学性质,试题有利于提高学生的分析、理解能力及综合应用能力.

练习册系列答案
相关题目
17.徐光宪在《分子共和国》一书中介绍了许多明星分子,如H2O2、CO2、BF3、CH3COOH等.下列说法正确的是( )
| A. | H2O2分子的空间构型为直线形 | |
| B. | CO2分子为含有极性键的极性分子 | |
| C. | BF3分子中的B原子不满足8电子稳定结构 | |
| D. | CH3COOH分子中C原子均为sp2杂化 |
18.短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的.由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生.下列说法不正确的是( )
| A. | X的简单氢化物的热稳定性比W强 | |
| B. | Y的简单离子与X的具有相同的电子层结构 | |
| C. | Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红 | |
| D. | Z与X属于同一主族,与Y属于同一周期 |
14.用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液.下列叙述错误的是( )
| A. | 待加工铝质工件为阳极 | |
| B. | 可选用不锈钢网作为阴极 | |
| C. | 阴极的电极反应式为:Al3++3e-═Al | |
| D. | 硫酸根离子在电解过程中向阳极移动 |
1.Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示.由图可知,当铁的浸出率为70%时,所采用的实验条件为100℃、2h或90℃、5h.

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O.
(3)TiO2•xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
分析40℃时TiO2•xH2O转化率最高的原因温度高反应速率加快,但温度过高过氧化氢分解、氨水易挥发,影响转化率.
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为4.
(5)若“滤液②”中c(Mg2+)=0.02mol•L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5,此时是否有Mg3(PO4)2沉淀生成?c(PO43-)=$\frac{1.3×1{0}^{22}}{1×1{0}^{-5}}$=1.0×10-17mol/L,Qc[Mg3(PO4)2]=($\frac{0.02mol/L}{2}$)3×(1.0×10-17mol/L)2=1.69×10-40<Ksp=1.0×10-24,则无沉淀生成(列式计算).FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式2FePO4+Li2CO3+H2C2O4$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+H2O+3CO2↑.

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示.由图可知,当铁的浸出率为70%时,所采用的实验条件为100℃、2h或90℃、5h.

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O.
(3)TiO2•xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2•xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为4.
(5)若“滤液②”中c(Mg2+)=0.02mol•L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5,此时是否有Mg3(PO4)2沉淀生成?c(PO43-)=$\frac{1.3×1{0}^{22}}{1×1{0}^{-5}}$=1.0×10-17mol/L,Qc[Mg3(PO4)2]=($\frac{0.02mol/L}{2}$)3×(1.0×10-17mol/L)2=1.69×10-40<Ksp=1.0×10-24,则无沉淀生成(列式计算).FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式2FePO4+Li2CO3+H2C2O4$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+H2O+3CO2↑.
11.化学与生活密切相关.下列说法错误的是( )
| A. | PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物 | |
| B. | 绿色化学要求从源头上消除或减少生产活动对环境的污染 | |
| C. | 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放 | |
| D. | 天然气和液化石油气是我国目前推广使用的清洁燃料 |
1.下列说法正确的是( )
| A. | 石油液化气的主要成份为甲烷 | |
| B. | 燃料的脱硫、脱氮都是减少酸雨产生的措施 | |
| C. | BaSO4难溶于水是弱电解质,在医学上用作钡餐 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
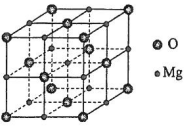 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题: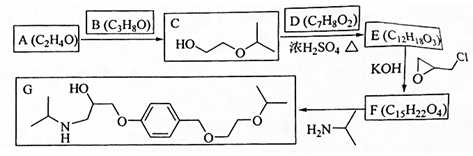
 .
.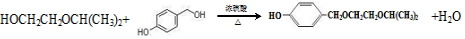 .
. 、
、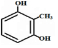 .
.