题目内容
6. 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.根据要求回答下列问题:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛.根据要求回答下列问题:(1)基态Ni的价电子排布式为3d84s2.
(2)Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂,则Ni(CO)4属于分子晶体.
(3)Ni2+可与丁二酮肟(
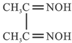 )作用生成腥红色配合物沉淀A.
)作用生成腥红色配合物沉淀A.①丁二酮肟分子中碳原子的杂化轨道类型有sp3和sp2,1mol该分子中含有的碳碳σ键和碳氮σ键的总数为5NA.
②氨气在水中的溶解度远大于甲烷,其原因是氨分子与水分子间形成氢键,而甲烷分子不能.
(4)据报道,某种含有镁、镍和碳三种元素的晶体具有超导性,该新型超导晶体的一个晶胞的结构如图所示,则该晶体的化学式为MgNi3C.
已知晶胞参数为a nm,列示计算该晶体的密度$\frac{213}{({a×1{0}^{-7})}^{3}{N}_{A}}$g•cm-3(不用算出结果)
分析 (1)Ni是28号元素,根据能量最低原则、泡利不相容原理和洪特规则,写出其核外电子排布式为:1s22s22p43s23p43d84s2,据此判断其价电子排布式;
(2)根据分子晶体的熔沸点较低分析;
(3)①根据价层电子对互斥理论确定中心原子杂化方式;C-C为碳碳σ键,C=N含有一个碳氮σ键;
②氢键的存在影响物质的熔沸点和溶解性;
(4)利用均摊法确定晶胞的化学式;根据$ρ=\frac{m}{V}$计算密度;
解答 解:(1)Ni是28号元素,其核外电子排布式为:1s22s22p43s23p43d84s2,价电子数为10,价电子排布式为3d84s2;
故答案为:3d84s2;
(2)Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂,则Ni(CO)4属于分子晶体;
故答案为:分子;
(3)①甲基上碳原子价层电子对个数是4且不含孤电子对,为sp3杂化,连接甲基的碳原子含有3个价层电子对且不含孤电子对,为sp2杂化;C-C为碳碳σ键,C=N含有一个碳氮σ键,则1mol该分子中含有的碳碳σ键和碳氮σ键的总数为5NA;
故答案为:sp3和sp2;5NA;
②N、O、F原子易形成氢键,氢键的存在影响物质的熔沸点和溶解性,所以NH3与H2O分子间存在氢键,甲烷分子与H2O分子间不存在氢键,所以氨气的溶解性大;
故答案为:氨分子与水分子间形成氢键,而甲烷分子不能;
(4)碳原子位于该晶胞的体心上,所以该晶胞中含有一个碳原子;镁原子个数=$\frac{1}{8}$×8,所以该晶胞含有1个镁原子;镍原子个数=$\frac{1}{2}$×6,该晶胞中含有3个镍原子,所以该晶胞的化学式为MgNi3C;晶胞参数为a nm,所以晶胞的体积为(a×10-7)3cm3,所以该晶体的密度为$\frac{\frac{213}{{N}_{A}}g}{(a×10{\;}^{-7}){\;}^{3}cm{\;}^{3}}$=$\frac{213}{({a×1{0}^{-7})}^{3}{N}_{A}}$g/cm3,
故答案为:MgNi3C;$\frac{213}{({a×1{0}^{-7})}^{3}{N}_{A}}$.
点评 本题考查晶体的结构与物质的性质的相互关系及应用,做题时注意电子排布式的书写方法,氢键,分杂化类型的判断方法以及晶胞的有关计算,注意学习中有关做题方法的积累.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案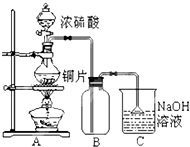 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:无必要,随着反应的进行,浓硫酸变成稀硫酸,稀硫酸与铜不反应
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:A
A.铁粉 B.钠 C.氯化钡溶液 D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度.他设计了如下二种方案来测定SO2的量:
方案①将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
方案②将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀.
经仔细分析后,发现有不合理之处,请填写表格(可以不填满):
| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | 高锰酸钾溶液中含有硫酸,与氯化钡反应,使生成的沉淀增多 | 偏低 | 将硫酸酸化的高锰酸钾溶液换成溴水或碘水或硝酸溶液 |
| 方案② | 不填 | 不填 | 不填 |
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)反应结束后将烧瓶中的铜片取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量.
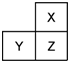 X、Y、Z是三种短周期的主族元素,在周期表中的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X、Y、Z是三种短周期的主族元素,在周期表中的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A. | 气态氢化物的热稳定性:X>Z | |
| B. | 原子半径:X<Y<Z | |
| C. | Y和Z的最高价氧化物对应水化物均为强酸 | |
| D. | 若Z的最高正价为+m,则X的最高正价也一定为+m |
| A. | 次氯酸具有强氧化性,可以起到除去水中悬浮的杂质和杀菌消毒作用 | |
| B. | 为防止中秋月饼等富脂食品氧化变质,常在包装中放入生石灰 | |
| C. | 金属汞一旦洒落在地面或桌面时,必须尽可能收集,并深埋处理 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
| A. | 1mol MgCl2中含有的离子数为3NA | |
| B. | 标况下3.36LCCl4中所含碳原子数约为0.15×6.02×1023 | |
| C. | 标准状况下,22.4L氦气与22.4L氯气所含原子数均为2NA | |
| D. | 标准状况下,1molCl2在反应中一定得到2NA电子 |
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 | |
| C. | 有单质参加或生成的反应不一定属于氧化还原反应 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
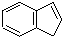 .下列关于茚的说法中不正确的是( )
.下列关于茚的说法中不正确的是( )| A. | 茚能使酸性高锰酸钾溶液褪色 | |
| B. | 茚能使溴的四氯化碳溶液褪色 | |
| C. | 1 mol茚只含有1 mol碳碳双键 | |
| D. | 茚中所有的原子均可能处在同一平面上 |

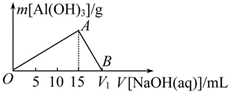 向20mL某浓度的AlCl3溶液中滴加2mol•L-1的NaOH溶液时,所得沉淀的质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL某浓度的AlCl3溶液中滴加2mol•L-1的NaOH溶液时,所得沉淀的质量与加入NaOH溶液的体积之间的关系如图所示: