题目内容
(10分) 高炉炼铁过程中发生的主要反应为 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=____________,ΔH______0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000℃ 时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=__________________、CO的平衡转化率=__________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是__________。
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
(1)c(CO2) / c(CO) <(2)0.006mol/(L·min) 60﹪(3)C
【解析】
试题分析:(1)固体的浓度看成是一个常数,不写在平衡常数表达式中,故K=c(CO2) / c(CO),根据表格给出的数据知道温度升高K减小,说明温度升高平衡向逆向移动,逆反应方向就是吸热反应,那么正反应就是放热反应,ΔH < 0(2)先比较浓度商和平衡常数的关系Q=c(CO2) / c(CO)=0.1 mol/L /0.1 mol/L =1 <K=4.0,所以反应向正向进行,设CO浓度变化了x,有:
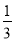 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
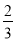 Fe(s)+CO2(g)
Fe(s)+CO2(g)
起始浓度(mol/L) 0. 1 0. 1
变化浓度(mol/L) x x
平衡浓度(mol/L) 0.1-x 0.1+x (1+x)/(1-x)=4.0 得x=0.06 mol/L, v(CO2)=0.06 mol/L÷10min=0.006mol/(L·min),CO的平衡转化率=0.06 mol/L÷0.1mol/L=0.6=60﹪(3)要提高CO的转化率,就要让平衡向正向移动, Fe和Fe2O3 都是固体,改变它们的量对反应体系的浓度没有影响,故平衡不发生移动,A、B 不可行; 移出部分CO2,使生成物的浓度减小,平衡向正向移动,C对;反应时放热反应,提高反应温度平衡向逆向移动,D错;减小容器的容积,增大压强,但反应两边气体的化学计量数相等,平衡不移动,E错;催化剂不能让平衡发生移动,F错,选C。
考点:平衡常数和转化率的计算、化学平衡的移动。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案


 K++H++SO42-
K++H++SO42-