题目内容
(1)将ag氯化钙溶于1.8L水中,恰好使钙离子数与水分子数之比为1:100,则a值为 。
(2)在反应2A+B=3C+2D中,已知3.4gA与3.2gB完全反应,生成4.8gC,又知道D的式量为18,则B的式量是
(3)25.4g 某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是 ;A的相对原子质量是 ;ACl2的化学式是 。
(4) 某混合物由Na2SO4、Al2(SO4)3组成,已知Na、Al两元素的质量之比为23: 9,则Na2SO4和Al2(SO4)3物质的量之比为 ,含1.00mol SO42–的该混合物的质量为 。
(1)111
(2)64
(3)127g/mol 56 FeCl2
(4)3:1 128g
【解析】
试题分析:(1)ag氯化钙含有钙离子的物质的量n(Ca2+)为a/111 mol。1.8L水含有水的质量m(H2O)为1.8L/1g/cm3=1800g。则物质的量n(H2O)=1800g/18g/mol=100mol。n(Ca2+):n(H2O)=1:100.所以a=111。
(2)根据质量守恒可知,生成D的质量为1.8g。则n(D)=1.8g/18g/mol=0.1mol,n(D):n(B)=2:1,所以n(B)=0.05mol。MB=3.2g/0.05mol=64g/mol。
(3)因氯化物ACl2中含有0.4molCl-可知,氯化物ACl2的物质的量为0.4mol/2=0.2mol,
则M(ACl2)=25.4g/0.2mol=127g/mol,所以ACl2相对分子质量为127,A的相对原子量为127-71=56,A为铁元素,ACl2的化学式FeCl2。
(4)设Na2SO4的物质的量为n1,Al2(SO4)3的物质的量为n2,则n(SO42-)= n1+3 n2Na、Al两元素的质量之比为23: 9,即(2 n1*23):(2 n2*27)=23:9。则两者的物质的量之比为n1: n2=3:1。若n1+3 n2=1.00mol,则n1=0.5mol, n2=1/6mol。所以混合物的质量为0.5mol*142g/mol+1/6mol*342g/mol=128g。
考点:化学计算

TMB是一种新型指纹检测的色原试剂,由碳、氢、氮三种元素组成,与氢气的相对分子质量之比为120。某研究性学习小组的同学欲利用下列仪器测定TMB的分子式。其主要过程为在足量氧气流中将4.80 g TMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2。请从图中选择适当的装置(装置符合气密性要求,加热装置等已略去,其他用品可自选)。
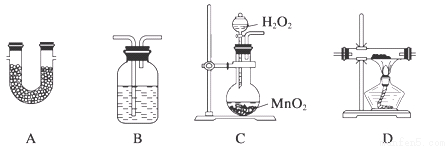
(1)将所选用的仪器(可重复选用)连接顺序由上到下依次填入下表,并写出该仪器中应加入的试剂的名称及作用。
选用的仪器 | 加入试剂 | 加入试剂的作用 |
C | H2O2溶液与MnO2 | 产生氧气 |
|
|
|
|
|
|
D | CuO粉末 | 将可能生成的CO转化为CO2 |
|
|
|
|
|
|
|
|
|
(2)实验后称得A及以后的装置(均用A装置并假设每次吸收均是完全的)质量依次增加3.60 g、14.08 g、0.14 g,则TMB的分子式为__________________________。