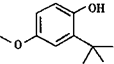
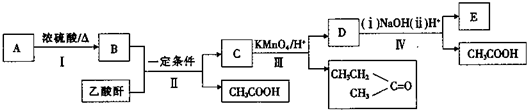
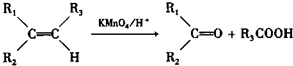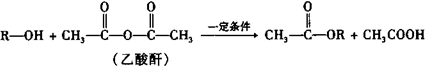题目内容
下列关于实验现象的描述不正确的是( )
| A、把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| B、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| C、用铜片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面出现一层铜 |
| D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
考点:铜金属及其重要化合物的主要性质,原电池和电解池的工作原理,化学反应速率的影响因素
专题:基本概念与基本理论,元素及其化合物
分析:A、铜的金属活动性不及铁,不能置换金属铁;
B、铜片和铁片和稀硫酸构成原电池,铜作负极;
C、阳极是活性金属铜,所以阳极金属铜失去电子发生氧化反应,阴极上溶液中的阳离子即铜离子得到电子变成铜,在铁极上析出;
D、构成原电池反应,可以加速反应的速率.
B、铜片和铁片和稀硫酸构成原电池,铜作负极;
C、阳极是活性金属铜,所以阳极金属铜失去电子发生氧化反应,阴极上溶液中的阳离子即铜离子得到电子变成铜,在铁极上析出;
D、构成原电池反应,可以加速反应的速率.
解答:
解:A、把铜片插入三氯化铁溶液中,铜和氯化铁反应生成氯化铜和氯化亚铁,铜的金属活动性不及铁,铜不能置换出铁,故A错误;
B、把铜片和铁片紧靠在一起浸入稀硫酸中,形成铜、铁、稀硫酸原电池,正极是金属铜,该极上电子和溶液中的氢离子结合产生氢气,故B正确;
C、用铜片做阳极,铁片做做阴极,电解氯化铜溶液,这是一个电镀池,镀层金属铜作阳极,待镀件铁作阴极,镀层金属盐氯化铜溶液作电解质,发生反应:阳极:Cu-2e-=Cu2+;阴极:Cu2++2e-=Cu,故C正确;
D、把锌片放入盛盐酸的试管中,加入几滴氯化铜溶液,锌置换出铜,所以形成了铜、锌、稀盐酸原电池,原电池反应可以加速反应的速率,故D正确;
故选A.
B、把铜片和铁片紧靠在一起浸入稀硫酸中,形成铜、铁、稀硫酸原电池,正极是金属铜,该极上电子和溶液中的氢离子结合产生氢气,故B正确;
C、用铜片做阳极,铁片做做阴极,电解氯化铜溶液,这是一个电镀池,镀层金属铜作阳极,待镀件铁作阴极,镀层金属盐氯化铜溶液作电解质,发生反应:阳极:Cu-2e-=Cu2+;阴极:Cu2++2e-=Cu,故C正确;
D、把锌片放入盛盐酸的试管中,加入几滴氯化铜溶液,锌置换出铜,所以形成了铜、锌、稀盐酸原电池,原电池反应可以加速反应的速率,故D正确;
故选A.
点评:本题主要考查了原电池的有关应用,解答须理解原电池的构成条件反应原理,题目较简单.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
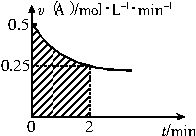 某溶液中发生反应A
某溶液中发生反应A| 无 |
| 无 |
| A、反应开始的前2min,A的平均反应速率小于0.375mol?L-1?min-1 |
| B、图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值 |
| C、图中阴影部分的面积表示0~2min内A的物质的量的减小值 |
| D、至2min时,B的物质的量浓度c(B)介于1~1.5mol?L-1之间 |
在某100mL混合酸中,硝酸物质的量浓度为0.4mol/L,硫酸物质的量浓度为0.2mol/L,向其中加入3.2g铜粉,微热,待其充分反应后,溶液中铜离子的物质的量浓度约为( )
| A、0.15mol/L |
| B、0.3mol/L |
| C、0.5mol/L |
| D、无法计算 |
把足量的小苏打固体和少量的过氧化钠固体混合均匀后充分加热,最后留下的固体物质的化学式是( )
| A、Na2CO3 |
| B、NaOH和Na2CO3 |
| C、Na2O2和Na2CO3 |
| D、Na2O2、NaOH和Na2CO3 |
下列物质中,只含离子键的是( )
| A、NH4Cl |
| B、CaCl2 |
| C、HCl |
| D、NaOH |