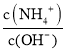题目内容
【题目】工业上可在高纯度氨气下,通过球磨氢化锂的方式合成高纯度的储氢材料氨基锂,该过程中发生反应:LiH(s)+NH3(g)=LiNH2(s)+H2 (g)。如图表示在0.3 MPa下,不同球磨时间的目标产物LiNH2的相对纯度变化曲线。下列说法正确的是 ( )

A.工业生产中,在0.3 MPa下合成LiNH2的最佳球磨时间是2.0 h
B.投入定量的反应物,平衡时混合气体的平均摩尔质量越大,LiNH2的相对纯度越高
C.在0.3 MPa下,若平衡时H2的物质的量分数为60%,则该反应的平衡常数K=1.5
D.LiH和LiNH2都能在水溶液中稳定存在
【答案】C
【解析】
A、2.0h LiNH2的相对纯度与1.5h差不多,耗时长但相对纯度提高不大,故A错误;
B、平衡时混合气体的平均摩尔质量越大,说明氨气的含量越多,正向反应程度越小,LiNH2的相对纯度越低,故B错误;
C、K=![]() =
=![]() =1.5,故C正确;
=1.5,故C正确;
D、LiH和LiNH2均极易与水反应:LiH+H2O=LiOH+H2↑和LiNH2+H2O=LiOH+NH3↑,都不能在水溶液中稳定存在,故D错误。
答案选C。

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目