题目内容
下列说法中正确的是( )
| A、SO2和O3、PO43-和C1O4-互为等电子体 | B、甲烷分子失去一个H+,形成CH3-,其碳原子的杂化类型发生了改变 | C、CH4、BCl3、SO2都是含有极性键的非极性分子 | D、所有元素的基态原子核外电子排布都遵循构造原理 |
分析:A、有相同原子数和最外层电子数的分子或离子叫等电子体;
B、根据C原子的价层电子对数分析;
C、不同非金属元素之间形成极性键,分子结构不对称,正负电荷的中心不重合的分子为极性分子,而结构对称且正负电荷的中心重合的分子为非极性分子;
D、不是所有元素的基态原子核外电子排布都遵循构造原理.
B、根据C原子的价层电子对数分析;
C、不同非金属元素之间形成极性键,分子结构不对称,正负电荷的中心不重合的分子为极性分子,而结构对称且正负电荷的中心重合的分子为非极性分子;
D、不是所有元素的基态原子核外电子排布都遵循构造原理.
解答:解:A、SO2和O3、PO43-和C1O4-它们有相同原子数和最外层电子数互为等电子体,故A正确;
B、甲烷分子(CH4)失去一个H+,形成甲基阴离子(CH3-),两微粒中C原子的价层电子对数都是为4,碳原子杂化方式不变,故B错误;
C、CH4、BCl3分子中含有极性键,由于分子结构对称,为非极性分子;SO2分子中含有极性键,由于分子结构不对称,为极性分子,故C错误;
D、不是所有元素的基态原子核外电子排布都遵循构造原理,处于半满或全满时能量低较稳定,如Cu的外围电子排布是3d104s1,不遵循构造原理,故D错误;
故选A.
B、甲烷分子(CH4)失去一个H+,形成甲基阴离子(CH3-),两微粒中C原子的价层电子对数都是为4,碳原子杂化方式不变,故B错误;
C、CH4、BCl3分子中含有极性键,由于分子结构对称,为非极性分子;SO2分子中含有极性键,由于分子结构不对称,为极性分子,故C错误;
D、不是所有元素的基态原子核外电子排布都遵循构造原理,处于半满或全满时能量低较稳定,如Cu的外围电子排布是3d104s1,不遵循构造原理,故D错误;
故选A.
点评:本题考查了等电子体、杂化类型的判断、非极性分子的判断、电子排布式等,题目涉及的知识点较多,侧重于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、进行钠的有关性质实验时,用剩的钠应放回原试剂瓶 | B、常用25.00 ml 碱式滴定管准确量取20.00 ml KMnO4溶液 | C、用湿润的淀粉碘化钾试纸可以鉴别NO2和Br2蒸气 | D、某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
Na3N和NaH都是离子化合物,与水反应都有气体生成,下列说法中正确的是( )
| A、两种物质的阴离子半径都比阳离子半径小 | B、溶于水,所得溶液都能使无色酚酞变红 | C、与水反应时,水都做氧化剂 | D、与盐酸反应都只生成一种盐 |
下列说法中正确的是( )
| A、用碱石灰除去氯气中的水 | B、碘化银是重要的感光材料,溴化银可用于人工降雨 | C、过氧化钠可用作潜艇里氧气的来源 | D、焰色反应实验中用硫酸清洗铁丝,灼烧后再沾取试样在酒精灯上灼烧观察 |
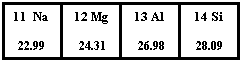 如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )
如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )| A、Si元素的名称是硅,其核电荷数为14 | B、Mg原子的结构示意图是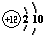 | C、Al的相对原子质量是26.98g | D、它们都属于金属元素 |
下列说法中正确的是( )
| A、O、Na、S元素的原子半径依次增大 | B、KOH、Mg(OH)2、Ba(OH)2的碱性依次增强 | C、H2SO4、H3PO4、HClO4的酸性依次增强 | D、F2、Cl2、Br2、I2的氧化性依次减弱 |