题目内容
【题目】某强酸性溶液 X 中可能含有 Fe2+、Fe3+、Al3+、Ba2+、NH4+、CO32-、NO3-、SO42-、SiO32-中的若干种,现取 X 溶液进行连续实验,实验过程及产物如图所示。实验过程中有一种气体为红棕色。
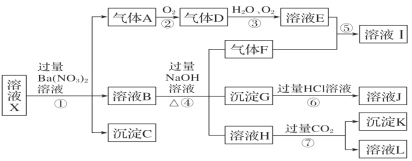
根据以上信息,回答下列问题:
(1)由强酸性条件即可判断 X 溶液中肯定不存在的离子有_____。
(2)溶液 X 中关于硝酸根离子的判断,正确的是_____(填编号,下同)。
a.一定含有 b.一定不含有 c.可能含有
(3)气体 F 的电子式为_____,化合物 I 中含有的化学键类型有_____。
(4)转化①的离子方程式为_____。 转化⑦的离子方程式为_________。
(5)对不能确定是否存在的离子,可以另取 X 溶液,加入下列溶液中的一种,根据现象即可判断, 该试剂最好是_____。
①NaOH 溶液 ②KSCN 溶液 ③氯水和 KSCN 的混合溶液 ④pH 试纸 ⑤KMnO4 溶液
【答案】CO32-、SiO32-b![]() 共价键和离子键3Fe2+ +4H+ +NO3-= 3Fe3++NO↑ + 2H2OAlO2-+2H2O+CO2===HCO3-+Al(OH) 3 ↓②
共价键和离子键3Fe2+ +4H+ +NO3-= 3Fe3++NO↑ + 2H2OAlO2-+2H2O+CO2===HCO3-+Al(OH) 3 ↓②
【解析】
某强酸性溶液X中一定含有氢离子,一定不含CO32-、SiO32-,加过量的硝酸钡溶液,产生白色沉淀C是硫酸钡,一定含有SO42-,一定不含Ba2+,产生气体A一定是亚铁离子和硝酸根离子、氢离子发生氧化还原反应得到的NO,所以一定含有Fe2+,一定不含NO3-,NO遇到氧气转化为气体D为二氧化氮,二氧化氮与水、氧气反应生成溶液E为硝酸溶液,溶液B中加入过量氢氧化钠生成气体F,F为氨气,则原溶液中一定含有NH4+,氨气和硝酸溶液反应生成I为硝酸铵,溶液H中通入过量二氧化碳产生沉淀K和溶液L,沉淀K一定为氢氧化铝,原溶液中一定含有Al3+,L是NaHCO3,溶液B中生成的有铁离子,所以沉淀G是Fe(OH)3,溶于盐酸得到J为氯化铁溶液,但原溶液中不一定含有Fe3+。
(1). 由强酸性条件即可判断X溶液中肯定不存在的离子有CO32-、SiO32-,故答案为:CO32-、SiO32-;
(2).根据上述分析可知,原溶液中一定会有H+、Fe2+,则一定不含NO3-,故答案为:b;
(3).气体F为NH3,电子式为![]() ,氨气和硝酸溶液反应生成化合物I为硝酸铵,硝酸铵中含有共价键和离子键,故答案为:
,氨气和硝酸溶液反应生成化合物I为硝酸铵,硝酸铵中含有共价键和离子键,故答案为:![]() ;共价键和离子键;
;共价键和离子键;
(4).由上述分析可知,转化①为H+、NO3-和Fe2+发生氧化还原反应生成Fe3+、NO和水,离子方程式为3Fe2+ +4H+ +NO3-= 3Fe3++NO↑ + 2H2O,转化⑦为过量CO2与AlO2-、H2O反应生成Al(OH) 3沉淀和HCO3-,离子方程式为AlO2-+2H2O+CO2=HCO3-+Al(OH) 3 ↓,故答案为:3Fe2+ +4H+ +NO3-= 3Fe3++NO↑ + 2H2O;AlO2-+2H2O+CO2=HCO3-+Al(OH) 3 ↓;
(5).由上述分析可知,不能确定X溶液中是否含有Fe3+,检验Fe3+最好的是试剂是KSCN溶液,故答案为:②。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】下表是元素周期表的一部分,表中序号分别代表某一元素![]() 请回答下列问题.
请回答下列问题.
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 |
|
|
|
| ||||
3 |
|
|
|
|
|
|
![]() 中,最活泼的金属元素是 ______(写元素符号,下同);最不活泼的元素是 ______ ;可作半导体材料的元素是 ______ ;某元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该元素是______.
中,最活泼的金属元素是 ______(写元素符号,下同);最不活泼的元素是 ______ ;可作半导体材料的元素是 ______ ;某元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该元素是______.
![]() 、
、![]() 的简单离子,其半径更大的是 ______ (写离子符号).
的简单离子,其半径更大的是 ______ (写离子符号).
![]() 、
、![]() 的气态氢化物,更稳定的是 ______ (填化学式).
的气态氢化物,更稳定的是 ______ (填化学式).
![]() 元素的非金属性:
元素的非金属性:![]() ______
______ ![]() 填“
填“![]() ”或“
”或“![]() ”).
”).
![]() 的最高价氧化物的水化物中:碱性最强的是 ______ (填化学式),酸性最强的是 _____ (填化学式); 酸性最强的物质与
的最高价氧化物的水化物中:碱性最强的是 ______ (填化学式),酸性最强的是 _____ (填化学式); 酸性最强的物质与![]() 的最高价氧化物对应的水化物反应的离子方程式为 ______________________________ .
的最高价氧化物对应的水化物反应的离子方程式为 ______________________________ .