题目内容
2. 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.(1)丙烯是石化工业的主要原料之一,由于市场对丙烯的需求量激增,丙烷脱氢制丙烯的技术日益受到重视.某研究机构需得到C3H8(g)═3C(石墨,s)+4H2(g)的△H,但直接测定实验难进行,可通过图中各组物质能量总和及相互间转化中的能量变化计算得到:
①判断:△H>0(选填“>”、“<”或“=”).
②△H=△H1-△H2-△H3(用含△H1、△H2、△H3的代数式表示).
(2)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol
(3 )由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.已知反应N2(g)+3H2(g)?2NH3(g)△H=akJ•mol-1.试根据表中所列键能数据计算a的数值为:-93
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
已知:C(s,石墨)+O2(g)═CO2(g)△H=-393kJ•mol-1 ①
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 ②
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJ•mol-1 ③
根据盖斯定律,计算 298K时C(s,石墨)和H2(g)反应生成1mol C2H2(g)的焓变为+227.7kJ/mol.
分析 (1)①根据能量图,结合盖斯定律分析判断反应C3H8(g)═3C(石墨,s)+4H2(g)的△H;
②根据盖斯定律求解反应C3H8(g)═3C(石墨,s)+4H2(g)的△H;
(2)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(3)依据△H=反应物键能和-生成物键能和求算;
(4)可以先根据反应物和生成物书写化学方程式,根据盖斯定律计算反应的焓变,最后根据热化学方程式的书写方法来书写热化学方程式.
解答 解:(1)①根据能量图,对于反应C3H8(g)═3C(石墨,s)+4H2(g),能量是升高的,因此反应是吸热反应,该反应的焓变△H>0;
故答案为:>;
②根据盖斯定律,结合能能量图,该反应的焓变△H=-[△H2-(△H1-△H3)]=△H1-△H2-△H3;
故答案为:△H1-△H2-△H3;
(2)5gCH3OH在氧气中燃烧生成CO2和液态水,放出113.5kJ热量,64g即2molCH3OH在氧气中燃烧生成CO2和液态水,放出1452.8kJ热量,则热化学方程式为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol,
故答案为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol;
(3))△H=反应物键能和-生成物键能和=945KJ/mol+3×436KJ/mol-6×391KJ/mol=-93KJ/mol,即a=-93,
故答案为:-93;
(4)已知:①C (s,石墨)+O2(g)=CO2(g)△H1=-393kJ/mol;
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ/mol;
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O (l)△H3=-2599kJ/mol;
2C (s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$ 得到,
根据盖斯定律,反应焓变△H=2×△H1+△H2×$\frac{1}{2}$-△H3×$\frac{1}{2}$=+227.7kJ/mol,
故答案为:+227.7kJ/mol.
点评 本题考查学生盖斯定律的应用和热化学方程式的书写方面的知识,注意反应热等于反应物的总键能-生成物的总键能、盖斯定律的应用.题目难度不大,是基础题.

 同步奥数系列答案
同步奥数系列答案| A. | 简单离子的半径:r(D)>r(E)>r(B)>r(C) | |
| B. | 最高价氧化物对应水化物的酸性:E>D | |
| C. | A2B2、C2B2所含有的化学键类型完全相同 | |
| D. | A、B、C、D四种元素形成的化合物溶于水呈酸性 |
 25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述错误的是( )
25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述错误的是( )| A. | 随pH增大,c(CH3COOH)与c(CH3COO-)的比值减小 | |
| B. | pH=4的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 25℃时,CH3COOH的电离常数K=1×10-2.75 | |
| D. | pH=5的溶液中:c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol•L-1 |

(l)电解过程中,A 装置中可观察到的现象是X极产生无色气体,Y极产生黄绿色的气体,X极溶液变红.
(2)请选用上述仪器,组装一套检验产生氢气的装置:h→p→q→m→n→j→k→o[按气流方向(用“→”表示),用小写字母表示,装置不重复使用].
(3)某同学认为将E换成装有碱石灰的干燥管也可以达到相同效果,乙同学认为不合理,其理由是碱石灰不能除去混有的氨气,氨气与氧化铜反应产生水蒸气对实验干扰.
(4)设计实验检测阳极产生的气体成分(除水蒸气外).(所选的试剂用字母编号代替)限选试剂:
A、3mol/LNaOH溶液 B、品红 C、酸化的淀粉-KI溶液 D、KBr溶液
| 操作 | 现象和结论 |
| 将混合气体依次通入D(或B),足量的A,然后通入C | D变黄色(或B褪色),则混合气体有氯气;C变蓝,则混合气体含的氧气 |
(6)若实验时反接了正负极,则X极的电极方程式为Fe-2e-=Fe2+.
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-396 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=-286 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-896 kJ•mol-1 | |
| D. | CH3OH(l)+O2(g)=CO2(g)+2H2O (l)△H=-736 kJ•mol-1 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)③的单质在空气中充分燃烧的化学方程式是4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O.④与⑥形成的稳定化合物的电子式为
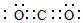 .
.(3)①、⑤、⑥三种元素形成的一种常见盐的化学式为NH4NO3,其中含有的化学键为离子键和共价键.
(4)高温灼烧由⑦与⑩形成的化合物时,火焰呈黄色.⑧可用于航空航天合金材料的制备,工业上冶炼该单质的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
| A. |  2-乙基丙烷 2-乙基丙烷 | B. | BrCH2CH2Br 二溴乙烷 | ||
| C. |  间二甲苯 间二甲苯 | D. |  2-甲基-1-丁烯 2-甲基-1-丁烯 |
 .B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如所示.
.B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如所示.