题目内容
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、含有NA个原子的氢气在标准状况下的体积约为22.4 L |
| B、25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA |
| C、40 g NaOH溶解在1 L水中,所制得的100 mL溶液中含Na+数为0.1NA |
| D、标准状况下,11.2 L H2O含有的分子数为0.5NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氢气为双原子分子,含有NA个原子的氢气的物质的量为0.5mol,标况下0.5mol氢气的体积为11.2L;
B.64g二氧化硫的物质的量为1mol,1mol二氧化硫中含有3mol原子;
C.氢氧化钠溶于1L水中,所得溶液的体积不是1L,无法计算氢氧化钠的浓度,则无法计算100mL溶液含有的钠离子数目;
D.标准状况下,水的状态不是气体,不能使用标况下的气体摩尔体积计算水的物质的量.
B.64g二氧化硫的物质的量为1mol,1mol二氧化硫中含有3mol原子;
C.氢氧化钠溶于1L水中,所得溶液的体积不是1L,无法计算氢氧化钠的浓度,则无法计算100mL溶液含有的钠离子数目;
D.标准状况下,水的状态不是气体,不能使用标况下的气体摩尔体积计算水的物质的量.
解答:
解:A.含有NA个原子的氢气的物质的量为0.5mol,标准状况下0.5mol氢气的体积约为11.2L,故A错误;
B.64g二氧化硫的物质的量为1mol,1mol二氧化硫中含有1molS、2molO原子,总共含有3mol原子,含有的原子数为3NA,故B正确;
C.40g氢氧化钠的物质的量为1mol,1mol氢氧化钠溶于1L水中,所得溶液体积不是1L,溶液的浓度不是1mol/L,则无法计算100mL溶液中含有的钠离子数目,故C错误;
D.标况下水不是气体,不能使用标况下的气体摩尔体积计算11.2L所得物质的量,故D错误;
故选B.
B.64g二氧化硫的物质的量为1mol,1mol二氧化硫中含有1molS、2molO原子,总共含有3mol原子,含有的原子数为3NA,故B正确;
C.40g氢氧化钠的物质的量为1mol,1mol氢氧化钠溶于1L水中,所得溶液体积不是1L,溶液的浓度不是1mol/L,则无法计算100mL溶液中含有的钠离子数目,故C错误;
D.标况下水不是气体,不能使用标况下的气体摩尔体积计算11.2L所得物质的量,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项C为易错点,注意氢氧化钠溶液1L水中,溶液体积不是1L.

练习册系列答案
相关题目
NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、1molH2O2与MnO2充分作用后,转移2NA个电子 | ||
| B、标准状况下,22.4升SO3含NA个分子 | ||
| C、常温常压下,1.6g O2和O3混合气体中质子总数为0.8NA | ||
D、标况下,NO和N2O的混合气体共a L,其中氧原子数约为
|
下列离子方程式书写正确的是( )
| A、小苏打中加入过量的石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | ||||
| B、氯气与石灰乳反应:Cl2+2OH-=Cl-+ClO-+H2O | ||||
| C、NH4HCO3溶液与过量NaOH溶液反应:NH4++HCO3-+OH-=CO32-+NH3+2H2O | ||||
D、偏铝酸钠溶液中通人过量的CO2:CO2+2H2O+AlO
|
甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-71kJ/mol
②CO(g)+2H2(g)=CH3OH(l)△H=-90.5kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol
下列说法不能得出的结论是( )
①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-71kJ/mol
②CO(g)+2H2(g)=CH3OH(l)△H=-90.5kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol
下列说法不能得出的结论是( )
| A、反应②不需要加热就能进行 |
| B、CO(g)+2H2(g)=CH3OH(g)△H>-90.5 kJ/mol |
| C、甲醇的燃烧热△H=-764 kJ/mol |
| D、若CO的燃烧热△H=-283.0 kJ/mol,则H2的燃烧热△H=-285.8 kJ/mol |
混合下列各组物质使之充分反应,再加热灼烧至质量不变,最终残留固体为纯净物的是( )
| A、向CuSO4溶液中加入适量铁粉 |
| B、等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液 |
| C、等物质的量的NaHCO3与Na2O2固体 |
| D、在NaBr溶液中充入过量氯气 |
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法不正确的是( )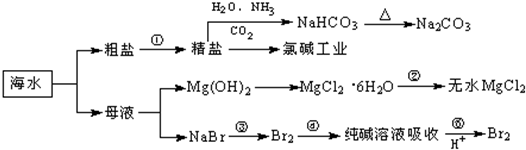

| A、由精盐制备NaHCO3的反应本质上属于复分解反应 |
| B、用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| C、氯碱工业是通过电解饱和食盐水得到烧碱、氯气和氢气;工业上制取金属镁是通过电解饱和MgCl2溶液 |
| D、在第④步反应中Br2既是氧化剂又是还原剂,在第⑤步反应中Br2既是氧化产物又是还原产物 |
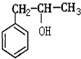 ; ②CH2=CHCOOCH3;③CH2=CHCH2OH; ④CH3CH2CH2OH; ⑤CH2=CHCOOH( )
; ②CH2=CHCOOCH3;③CH2=CHCH2OH; ④CH3CH2CH2OH; ⑤CH2=CHCOOH( )