题目内容
 在一固定容积的密闭容器中进行着反应:CO2(g)+H2(g)?CO(g)+H2O(g),其平衡常数K和温度的关系如下:
在一固定容积的密闭容器中进行着反应:CO2(g)+H2(g)?CO(g)+H2O(g),其平衡常数K和温度的关系如下:| t℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(2)平衡常数K表示的意义是
(3)能判断该反应是否已经达到化学平衡状态的是
(a) 容器中密度不变 (b) 混合气体中CO浓度不变(c) v(H2)正=v(H2O)逆(d)c(CO2)=c(CO)
(4)该反应的逆反应速率随时间变化情况如图所示.
①从如图可知,在t1时改变了某种反应条件,反应在t2时达到平衡,改变的条件可能是
a.升高温度 b.增大CO2的浓度c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在上图画出t3~t5时间段的v逆变化曲线.
考点:化学反应速率变化曲线及其应用,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)根据温度和平衡常数的变化关系确定反应的吸放热;
(2)平衡常数K是表示反应进行的程度大小的;
(3)化学平衡标志是正逆反应速率相同,各组分含量保持不变,各组分的浓度不随着时间的改变而改变,据此分析选项;
(4)①根据影响化学反应速率的因素来确定改变的条件;
②增加CO2的量,会促使平衡正向移动,正逆反应速率都要加快,据此回答.
(2)平衡常数K是表示反应进行的程度大小的;
(3)化学平衡标志是正逆反应速率相同,各组分含量保持不变,各组分的浓度不随着时间的改变而改变,据此分析选项;
(4)①根据影响化学反应速率的因素来确定改变的条件;
②增加CO2的量,会促使平衡正向移动,正逆反应速率都要加快,据此回答.
解答:
解:(1)根据温度和平衡常数的变化关系:温度升高,K降低,所以放应是放热的,故答案为:放热;
(2)平衡常数K的意义:是可逆反应进行程度的标志,一定温度下,K值越大,反应进行的程度越大,故答案为:K是可逆反应进行程度的标志,一定温度下,K值越大,反应进行的程度越大,反之则越小;
(3)(a) 容器中密度=
,质量守恒,V始终不变化,所以密度始终不变,当密度不变了,不一定平衡,故a错误;
(b) 混合气体中CO浓度不变是平衡状态的特征,故b正确;
(c) v(H2)正=v(H2O)逆能说明正逆反应的速率是相等的,达到平衡,故c正确;
(d)c(CO2)=c(CO)不能说明正逆反应的速率是相等的,达到平衡,故d错误.
故答案为:bc;
(4)①从如图可知,在t1时改变了某种反应条件,反应在t2时达到平衡,改变的条件使速率变化离开原速率点了,应该是同时能让正逆反应速率加快的条件,故答案为:ad;
②在t3时增加CO2的量,会使得正逆反应速率都加快,逆反应速率在原来的基础上逐渐加快,图为 ,故答案为:
,故答案为: .
.
(2)平衡常数K的意义:是可逆反应进行程度的标志,一定温度下,K值越大,反应进行的程度越大,故答案为:K是可逆反应进行程度的标志,一定温度下,K值越大,反应进行的程度越大,反之则越小;
(3)(a) 容器中密度=
| m |
| V |
(b) 混合气体中CO浓度不变是平衡状态的特征,故b正确;
(c) v(H2)正=v(H2O)逆能说明正逆反应的速率是相等的,达到平衡,故c正确;
(d)c(CO2)=c(CO)不能说明正逆反应的速率是相等的,达到平衡,故d错误.
故答案为:bc;
(4)①从如图可知,在t1时改变了某种反应条件,反应在t2时达到平衡,改变的条件使速率变化离开原速率点了,应该是同时能让正逆反应速率加快的条件,故答案为:ad;
②在t3时增加CO2的量,会使得正逆反应速率都加快,逆反应速率在原来的基础上逐渐加快,图为
 ,故答案为:
,故答案为: .
.
点评:本题考查学生化学平衡状态的判断、平衡常熟的意义以及影响化学反应速率的因素等知识,注意知识的归纳和梳理是解题的关键,难度中等.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
下列关于乙醇和乙酸的说法中,正确的是( )
| A、乙醇和乙酸在一定条件下能发生酯化反应 |
| B、乙酸能溶于水,但不溶于乙醇 |
| C、乙醇和乙酸均能使紫色石蕊试液变红 |
| D、乙醇和乙酸分子中都含有C=O键 |
已知c(NH4Cl)<0.1mol?L-1时,溶液的pH>5.1,现用0.1mol?L-1盐酸滴定10mL 0.05mol?L-1氨水,用甲基橙作指示剂,达到终点时所用盐酸的量应是( )
| A、10 mL |
| B、5 mL |
| C、大于5 mL |
| D、小于5 mL |
下列说法正确的是( )
| A、弱电解质的电离过程是吸热过程 |
| B、升高温度可以抑制盐类的水解 |
| C、正盐水溶液pH均为7 |
| D、硫酸钠水溶液pH小于7 |
在密闭容器中A与B反应生成C,其反应速率分别用v(A),v(B),v(C)表示,已知v(A),v(B),v(C)之间有以下关系3v(A)=2v(B),3v(C)=2v(B),则此反应可表示为( )
| A、2A+3B=2C |
| B、A+3B=2C |
| C、3A+B=2C |
| D、A+B=C |
 如图,Ⅰ是恒压密闭容器,Ⅱ是恒容刚性密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)?aZ(g).则Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容刚性密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)?aZ(g).则Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )| A、若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ<Ⅱ |
| B、若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ |
| C、若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间相同 |
| D、平衡时Ⅰ容器的体积小于V L |
下列关于金属腐蚀的说法中不正确的是( )
| A、金属腐蚀的本质是金属原子失去电子而被氧化 |
| B、金属腐蚀一般包括化学腐蚀和电化学腐蚀 |
| C、纯的金属一般难以发生电化学腐蚀 |
| D、镀锌铁当镀层破损后,镀层则对铁失去了保护作用 |
氢键既可以存在于分子之间,也可以存在于分子内部的原子团之间,如邻羟基苯甲醛分子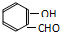 ) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子(
) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子( 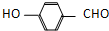 )之间存在氢键(分子间氢键).则两者的熔点、沸点的相对大小关系是( )
)之间存在氢键(分子间氢键).则两者的熔点、沸点的相对大小关系是( )
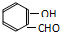 ) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子(
) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子(  )之间存在氢键(分子间氢键).则两者的熔点、沸点的相对大小关系是( )
)之间存在氢键(分子间氢键).则两者的熔点、沸点的相对大小关系是( )| A、前者>后者 | B、前者<后者 |
| C、前者=后者 | D、无法估计 |