题目内容
己知H2CO3的酸性强于H2S,将amol?L -1 NaHS与bmol?L-1NaOH两种稀溶液等体积混合(a>0,b>0),所得溶液中微粒间的物质的量浓度关系正确的是( )
| A、a=b时:c(OH-)=c(H+)+c(HS-) |
| B、a=2b时:c(S2-)>c(HS )>c(OH-)>c(H+) |
| C、a=3b时:C(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| D、a=4b时:4c(Na+)=5c(S2-)+5c(HS-)5c(H2S) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A、a=b时,将amol?L -1 NaHS与bmol?L-1NaOH两种稀溶液等体积混合发生反应NaHS+NaOH=Na2S+H2O,依据溶液中质子守恒分析判断;
B、a=2b时,将amol?L -1 NaHS与bmol?L-1NaOH两种稀溶液等体积混合得到溶液为等物质的量NaHS和Na2S的混合溶液,依据溶液中HS-水解程度大于电离分析离子浓度大小;
C、a=3b时,将amol?L -1 NaHS与bmol?L-1NaOH两种稀溶液等体积混合得到溶液为NaHS和Na2S的混合溶液,硫氢化钠物质的量为硫化钠的二倍,依据溶液电荷守恒分析;
D、a=4b时,将amol?L -1 NaHS与bmol?L-1NaOH两种稀溶液等体积混合得到溶液为NaHS和Na2S的混合溶液,硫氢化钠物质的量为硫化钠的三倍,依据溶液中物料守恒分析判断;
B、a=2b时,将amol?L -1 NaHS与bmol?L-1NaOH两种稀溶液等体积混合得到溶液为等物质的量NaHS和Na2S的混合溶液,依据溶液中HS-水解程度大于电离分析离子浓度大小;
C、a=3b时,将amol?L -1 NaHS与bmol?L-1NaOH两种稀溶液等体积混合得到溶液为NaHS和Na2S的混合溶液,硫氢化钠物质的量为硫化钠的二倍,依据溶液电荷守恒分析;
D、a=4b时,将amol?L -1 NaHS与bmol?L-1NaOH两种稀溶液等体积混合得到溶液为NaHS和Na2S的混合溶液,硫氢化钠物质的量为硫化钠的三倍,依据溶液中物料守恒分析判断;
解答:
解:A、a=b时,将amol?L -1 NaHS与bmol?L-1NaOH两种稀溶液等体积混合发生反应NaHS+NaOH=Na2S+H2O,依据溶液中质子守恒分析得到,c(OH-)=c(H+)+c(HS-)+2c(H2S),故A错误;
B、a=2b时,将amol?L -1 NaHS与bmol?L-1NaOH两种稀溶液等体积混合得到溶液为等物质的量NaHS和Na2S的混合溶液,依据溶液中HS-水解程度大于电离分析离子浓度大小为c(S2-)>c(OH-)>c(HS )>c(H+),故B错误;
C、a=3b时,将amol?L -1 NaHS与bmol?L-1NaOH两种稀溶液等体积混合得到溶液为NaHS和Na2S的混合溶液,硫氢化钠物质的量为硫化钠的二倍,溶液中存在电荷守恒为,C(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故C正确;
D、a=4b时,将amol?L -1 NaHS与bmol?L-1NaOH两种稀溶液等体积混合得到溶液为NaHS和Na2S的混合溶液,硫氢化钠物质的量为硫化钠的三倍,依据溶液中物料守恒分析得到,5c(Na+)=4c(S2-)+4c(HS-)+4c(H2S),故D错误;
B、a=2b时,将amol?L -1 NaHS与bmol?L-1NaOH两种稀溶液等体积混合得到溶液为等物质的量NaHS和Na2S的混合溶液,依据溶液中HS-水解程度大于电离分析离子浓度大小为c(S2-)>c(OH-)>c(HS )>c(H+),故B错误;
C、a=3b时,将amol?L -1 NaHS与bmol?L-1NaOH两种稀溶液等体积混合得到溶液为NaHS和Na2S的混合溶液,硫氢化钠物质的量为硫化钠的二倍,溶液中存在电荷守恒为,C(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故C正确;
D、a=4b时,将amol?L -1 NaHS与bmol?L-1NaOH两种稀溶液等体积混合得到溶液为NaHS和Na2S的混合溶液,硫氢化钠物质的量为硫化钠的三倍,依据溶液中物料守恒分析得到,5c(Na+)=4c(S2-)+4c(HS-)+4c(H2S),故D错误;
点评:本题考查了盐类水解的分析应用,溶液中离子浓度大小,电荷守恒和物料守恒的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
25℃的四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.有关上述溶液的比较中,正确的是( )
| A、水电离的c(H+):①=②=③=④ |
| B、将②、③溶液混合后,pH=7,消耗溶液的体积:②<③ |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:①最大 |
| D、向溶液中加入100mL水后,溶液的pH:③>④>①>② |
常温下,在下列溶液中一定能大量共存的离子组是( )
| A、FeSO4溶液中:K+、H+、Cl-、NO3- |
| B、c(OH-)/c(H+)=10-12的溶液中:NH4+、Cu2+、NO3-、Cl- |
| C、使甲基橙变黄的溶液中:Na+、K+、SO42-、AlO2- |
| D、和铝反应产生氢气的溶液中:K+、Ba2+、NO3-、HCO3- |
已知H2(g)+Cl2(g)═2HCl(g);△H=-184.6kJ?mol-1,则反应2HCl(g)═H2(g)+Cl2(g)的△H为( )
| A、+92.3 kJ?mol-1 |
| B、-92.3 kJ?mol-1 |
| C、-369.2 kJ?mol-1 |
| D、+184.6 kJ?mol-1 |
下列说法中用离子方程式表达正确的是( )


| A、用含氢氧化铝的药物治疗胃酸过多症:OH-+H+=H2O | ||||
B、用亚硫酸钾溶液吸收硫酸工业尾气中的SO2:SO2+S
| ||||
| C、右图所示电池的反应:Cu2++2Ag=Cu+2Ag+ | ||||
| D、用稀硫酸洗涤粘在试管壁上的氧化亚铜:Cu2O+2H+=2Cu2++H2O |
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+
Fe2++Cr3+.下列说法一定正确的是( )
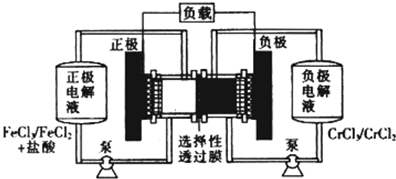
| 放电 |
| 充电 |

| A、充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B、电池放电肘,负极的电极反应式为Fe2+-e-=Fe3+ |
| C、电池放电时,Cl-从负极室穿过选择性透过膜移向正极室 |
| D、放电时,电路中每流过0.1 mol电子,Fe3+浓度降低0.1mol.L-1 |

 已知,中学化学常见的一些物质有如下图转化关系(转化关系中的某些产物已略去).其中,物质A、D、G是单质,D的单质在黄绿色气体中燃烧生成的产物溶于水得到E,黑色物质C有磁性是某金属矿物的主要成份,F是混合物,H是极易溶于水的碱性气体.
已知,中学化学常见的一些物质有如下图转化关系(转化关系中的某些产物已略去).其中,物质A、D、G是单质,D的单质在黄绿色气体中燃烧生成的产物溶于水得到E,黑色物质C有磁性是某金属矿物的主要成份,F是混合物,H是极易溶于水的碱性气体.