��Ŀ����
��ҵ��һ���ں����ܱ������в������з�Ӧ�ϳɼ״���CO(g)+2H2(g) CH3OH(g) ��H
CH3OH(g) ��H
(1)�жϷ�Ӧ�ﵽƽ��״̬�������ǣ�����ĸ��ţ��� ͬ��____��
A������CH3OH������������CO���������
B�����������ܶȲ���
C����������ƽ����Է�����������
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
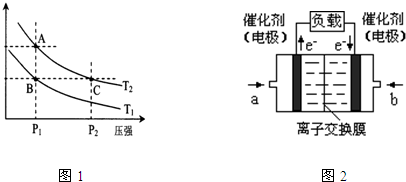
(2)�±����������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)��
 CH3OH(g) ��H
CH3OH(g) ��H(1)�жϷ�Ӧ�ﵽƽ��״̬�������ǣ�����ĸ��ţ��� ͬ��____��
A������CH3OH������������CO���������
B�����������ܶȲ���
C����������ƽ����Է�����������
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
(2)�±����������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)��

���ɱ��������жϡ�H____(�>������=���� ��<��)0��
��ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c(CO)= 0.2
mol/L����CO��ת����Ϊ____����ʱ���¶�Ϊ____��
(3)Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��_________��
a������ b��������� c������CO��Ũ�� d������H2��ѹ e��������������ѹ f��������״�
(4)300��ʱ����һ����ѹǿ�£�5 mol CO��������H2�ڴ�����������ǡ����ȫ��Ӧ�仯������Ϊ454
kJ���ڸ��¶�ʱ�����ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
��ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c(CO)= 0.2
mol/L����CO��ת����Ϊ____����ʱ���¶�Ϊ____��
(3)Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��_________��
a������ b��������� c������CO��Ũ�� d������H2��ѹ e��������������ѹ f��������״�
(4)300��ʱ����һ����ѹǿ�£�5 mol CO��������H2�ڴ�����������ǡ����ȫ��Ӧ�仯������Ϊ454
kJ���ڸ��¶�ʱ�����ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
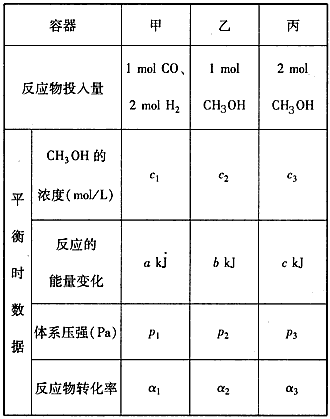
����˵����ȷ����_______
A��2c1>c3 B��a+b<90.8 C��2p2< p3 D����1+��3<1
A��2c1>c3 B��a+b<90.8 C��2p2< p3 D����1+��3<1
(1)CD
(2)��<����80%��250��
(3)df
(4)D
(2)��<����80%��250��
(3)df
(4)D

��ϰ��ϵ�д�
�����Ŀ
 CH3OH��g����H
CH3OH��g����H