题目内容
【题目】下表是元素周期表的一部分,请参照元素①—⑥的位置回答下列问题:
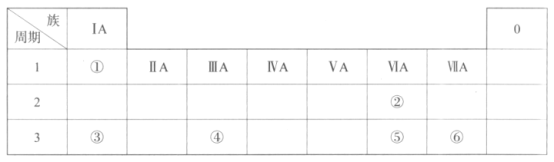
(1)元素①的一种核素中,含有1个质子和1个中子,表示该核素组成的符号是__。
(2)⑤的原子结构示意图是__。
(3)上述元素中,原子半径最大的是__(写元素符号)。
(4)仅由①、⑥组成的化合物的电子式为__,该化合物的分子中含有__(填“极性”或“非极性”)共价键。
(5)金属性:③__④(填“>”或“<”),列举一条能证明该结论的实验事实:__。
(6)下列说法正确的是__(填序号)。
a.②、③组成的化合物只有一种
b.②的气态氢化物稳定性高于⑤
c.⑥在化合物中呈现的最高化合价为+7价
【答案】![]() H
H ![]() Na
Na ![]() 极性 > 同条件下与同浓度盐酸反应Na比Al更容易 bc
极性 > 同条件下与同浓度盐酸反应Na比Al更容易 bc
【解析】
由表可知,①为H、②为O、③为Na、④为Al、⑤为S、⑥为Cl。
(1)元素①为H,H的一种核素中,含有1个质子和1个中子,其质量数为2,表示该核素组成的符号是为:![]() ;
;
(2)⑤为S,S原子的核电荷数是16,核外三个电子层,其结构示意图是:![]() ;
;
(3)同周期,从左到右,原子半径减小,同主族,从上到下,原子半径增大,所以原子半径最大的是:Na;
(4)①为H、⑥为Cl,组成的化合物是HCl,其电子式为![]() ,该化合物的分子中含有H-Cl之间的极性共价键;
,该化合物的分子中含有H-Cl之间的极性共价键;
(5)③为Na、④为Al,属于同周期元素,从左到右金属性减弱,其金属性:Na>Al,能证明该结论的实验事实是同等条件下与同浓度盐酸反应Na比Al更剧烈,故答案为:同条件下与同浓度盐酸反应Na比Al更剧烈;
(6)a. ②为O、③为Na,组成的化合物Na2O、Na2O2,a错误;
b. ②为O,⑤为S,属于同主族元素,从上到下,气态氢化物的稳定性减弱,所以气态氢化物的稳定性:H2O>H2S,b正确;
c. ⑥为Cl,最外层上的电子数是7,在化合物中呈现的最高化合价为+7价,c正确;
答案为:bc。

【题目】在钢铁工业中,锰的用量仅次于铁.锰的冶炼所用原料为锰矿石,主要含菱锰矿![]() ,另常含有
,另常含有![]() 、FeO、
、FeO、![]() 、NaCl和石灰等.
、NaCl和石灰等.
金属阳离子 |
|
|
|
|
|
开始至沉淀 完全的pH |
|
|
|
|
|
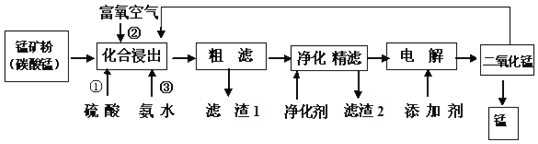
请回答下列问题:
![]() 在化合浸出中,为了提高浸出率提高产品纯度,通常采用______
在化合浸出中,为了提高浸出率提高产品纯度,通常采用______![]() 至少写两种方法
至少写两种方法![]()
![]() 在该工艺流程中滤渣1成分化学式为______;通常加入净化剂主要成分为
在该工艺流程中滤渣1成分化学式为______;通常加入净化剂主要成分为![]() ,滤渣2化学式为______.
,滤渣2化学式为______.
![]() 打捞韩国“岁月号”沉船是水下作业,潜水员需要呼吸的就是富氧空气.流程中用富氧空气作氧化剂,降低生产成本.流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是______
打捞韩国“岁月号”沉船是水下作业,潜水员需要呼吸的就是富氧空气.流程中用富氧空气作氧化剂,降低生产成本.流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是______
![]() 写出电解操作时阳极的电极反应式______.
写出电解操作时阳极的电极反应式______.
![]() 铝热法产生的废渣含有二氧化锰,可以作为氧化剂加入化合浸出,提高锰矿的利用率,则离子反应方程式是:______.
铝热法产生的废渣含有二氧化锰,可以作为氧化剂加入化合浸出,提高锰矿的利用率,则离子反应方程式是:______.
![]() 在电解液中
在电解液中![]() 不宜过大,否则在电解过程中会产生污染物,通常要定时检测
不宜过大,否则在电解过程中会产生污染物,通常要定时检测![]() 的大小,资料显示
的大小,资料显示![]() ,
,![]() ,且
,且![]() 为砖红色,通常采用
为砖红色,通常采用![]() 为滴定剂,用
为滴定剂,用![]() 作指示剂进行定量测定
作指示剂进行定量测定![]() 的大小.请描述该沉淀滴定终点时的现象:______;当
的大小.请描述该沉淀滴定终点时的现象:______;当![]() 沉淀完全时
沉淀完全时![]() 开始沉淀,此时溶液中
开始沉淀,此时溶液中![]() ______.
______.
【题目】有如下反应:
①3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O | ②H++OH-=H2O |
③2Fe+3Cl2 | ④NaHCO3+NaOH=Na2CO3+H2O |
⑤CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 | ⑥NaClO+CO2+H2O=HClO+NaHCO3 |
⑦2Al+2NaOH+2H2O=2NaAlO2+3H2↑ | ⑧CO2+H2O=H2CO3 |
请回答:
(1)上述反应中有电子转移的是___(填序号),因此该类反应属于__反应。
(2)反应⑤的离子方程式是__。
(3)上述反应中属于复分解反应的是__(填序号)。复分解反应发生的条件是i.生成沉淀,ii.放出气体,iii.生成水等难电离物质,若要由反应印证i、ii、iii,则除了这几个反应外,请补充反应:_(写一个符合条件的化学方程式或离子方程式)。
(4)由反应①及所学知识判断:在该反应发生的条件下,NO3-、H+、Cu2+的氧化性由大到小的顺序是___。
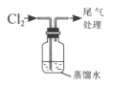
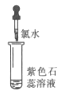
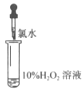
【题目】化学小组同学为探究氯水的成分及性质进行了如下实验:
实验① | 实验② | 实验③ | 实验④ | 实验⑤ | |
实验操作(氯水均为新制) |
|
|
|
|
|
实验现象 | 蒸馏水由无色逐渐变为浅黄绿色 | 溶液变蓝 | 石蕊溶液先变红,后褪色 | 产生白色沉淀 | 产生大量无色气泡 |
(试管中溶液均为1mL,均滴入氯水5滴)
(1)证明氯水中含有Cl-的是实验__(填序号),用离子方程式表示该实验中涉及的反应__。
(2)由实验②的现象可推断非金属性:Cl__I(填“>”或“<”),由原子结构解释其原因:Cl和I同主族,__,得电子能力:Cl>I(请补充完整)。
(3)实验③中溶液变红是由于溶液中含有__(填微粒符号,下同);使溶液褪色的微粒是__。
(4)同学们根据“H2O2在催化剂作用下可发生分解”的性质,认为实验⑤中现象不一定说明氧化性Cl2>H2O2。为证实Cl2将H2O2氧化,可继续补充实验:__(填操作、现象)。
(5)同学们发现久置的氯水会失去漂白性,溶液由黄绿色变为无色。为探究氯水失效的原因,进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如图曲线。
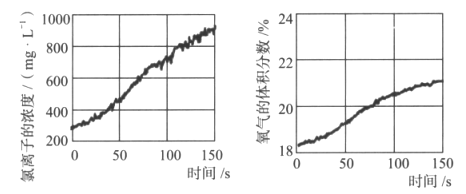
解释上两图中曲线变化的原因__。若在上述整个实验过程中测定溶液的pH,pH的变化是__。