题目内容
 A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.已知D原子最外层电子数是电子层数的3倍,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.已知D原子最外层电子数是电子层数的3倍,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.(1)C元素在周期表中的位置
(2)写出C元素的单质从A、B两元素组成的化合物的水溶液中置换出B元素的单质的离子方程式是
(3)A和D形成0.5mol化合物与足量水发生氧化还原反应时转移电子数是:
(4)B元素的单质在不同的条件下可以与O2发生一系列反应:
B(s)+O2(g)=BO2(g);△H=-296.8kJ?mol-1
2BO2(g)+O2(g)═2BO3(g);△H=-196.6kJ?mol-1
则BO3(g)若完全分解成B(s)时反应的热化学方程式为:
(5)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g)═2NH3(g);△H=-92.4kJ/mol
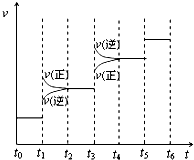
当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.图中t1 时引起平衡移动的条件可能是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D四种短周期元素,A、B、C同周期,则A、B、C在第二周期或第三周期,A的原子半径是同周期中最大的,则A在第一主族,D原子最外层电子数是电子层数的3倍,B、D同主族,B、D可能为第四主族或第六主族元素,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质,即C的非金属性比B的强,则A为钠元素,B为硫元素,C为氯元素,D为氧元素,
(1)根据C元素的原子结构判断其在周期表中的位置,电子层数=周期数,最外层电子数=族序数;
(2)根据氧化还原反应原理书写离子方程式;
(3)根据氧化还原反应方程式计算转移电子的物质的量;
(4)先根据方程式的加减得出1mol BO3(g)完全分解成B(s)的方程式,根据盖斯定律求得焓变,再写出热化学方程式;
(5)根据影响平衡移动的因素结合图象来分析.
(1)根据C元素的原子结构判断其在周期表中的位置,电子层数=周期数,最外层电子数=族序数;
(2)根据氧化还原反应原理书写离子方程式;
(3)根据氧化还原反应方程式计算转移电子的物质的量;
(4)先根据方程式的加减得出1mol BO3(g)完全分解成B(s)的方程式,根据盖斯定律求得焓变,再写出热化学方程式;
(5)根据影响平衡移动的因素结合图象来分析.
解答:
解:A、B、C、D四种短周期元素,A、B、C同周期,则A、B、C在第二周期或第三周期,A的原子半径是同周期中最大的,则A在第一主族,D原子最外层电子数是电子层数的3倍,B、D同主族,B、D可能为第四主族或第六主族元素,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质,即C的非金属性比B的强,则A为钠元素,B为硫元素,C为氯元素,D为氧元素,
依据分析可知:A为钠,B为硫,C为氯,D为氧,
(1)因C为氯元素,其质子数为17,电子排布中有3个电子层,最外层电子数为7,即其位置为第三周期、第VIIA族,故答案为:第三周期第VIIA族;
(2)C元素的单质为氯气,A、B两元素组成的化合物为硫化钠,它们反应的离子方程式为S2-+Cl2=2Cl-+S,故答案为:S2-+Cl2=2Cl-+S;
(3)A和D形成的化合物与水发生氧化还原反应,则A和D形成的化合物为Na2O2,每摩尔Na2O2与水反应时转移电子的物质的量为1mol,所以0.5molNa2O2与水反应时转移电子的物质的量为0.5mol,故答案为:0.5NA;
(4)因为B(s)+O2(g)=BO2(g);△H=-296.8kJ?mol-1 ①,2BO2(g)+O2(g)?2BO3(g);△H=-196.6kJ?mol-1 ②,将方程式①×2+②得方程式:2B(s)+3O2(g)=2BO3(g);△H=2×(-296.8kJ?mol-1 )+(-196.6kJ?mol-1)=-790.2KJ/mol,所以有BO3(g))=B(s)+3/2 O2(g)△H=+395.1kJ?mol-1,故答案为:BO3(g))=B(s)+
O2(g)△H=+395.1kJ?mol-1;
(5)由图象可知,t1时正逆反应速率都增大,则可能为加压或升温,该反应为放热反应,升高稳定,逆向移动,逆反应速率大于正反应速率,与图象不符,该反应是气体体积缩小的反应,加压正向移动,则正反应速率大于逆反应速率,与图象符合,则应为加压;显然图象中的t3时为升高温度,t1时加压正向移动,氨气的含量增大,t3时为升高温度,化学平衡逆向移动,氨气的含量降低,即t2-t3一段时间平衡混合物中NH3的含量最高;故答案为:加压; t2-t3.
依据分析可知:A为钠,B为硫,C为氯,D为氧,
(1)因C为氯元素,其质子数为17,电子排布中有3个电子层,最外层电子数为7,即其位置为第三周期、第VIIA族,故答案为:第三周期第VIIA族;
(2)C元素的单质为氯气,A、B两元素组成的化合物为硫化钠,它们反应的离子方程式为S2-+Cl2=2Cl-+S,故答案为:S2-+Cl2=2Cl-+S;
(3)A和D形成的化合物与水发生氧化还原反应,则A和D形成的化合物为Na2O2,每摩尔Na2O2与水反应时转移电子的物质的量为1mol,所以0.5molNa2O2与水反应时转移电子的物质的量为0.5mol,故答案为:0.5NA;
(4)因为B(s)+O2(g)=BO2(g);△H=-296.8kJ?mol-1 ①,2BO2(g)+O2(g)?2BO3(g);△H=-196.6kJ?mol-1 ②,将方程式①×2+②得方程式:2B(s)+3O2(g)=2BO3(g);△H=2×(-296.8kJ?mol-1 )+(-196.6kJ?mol-1)=-790.2KJ/mol,所以有BO3(g))=B(s)+3/2 O2(g)△H=+395.1kJ?mol-1,故答案为:BO3(g))=B(s)+
| 3 |
| 2 |
(5)由图象可知,t1时正逆反应速率都增大,则可能为加压或升温,该反应为放热反应,升高稳定,逆向移动,逆反应速率大于正反应速率,与图象不符,该反应是气体体积缩小的反应,加压正向移动,则正反应速率大于逆反应速率,与图象符合,则应为加压;显然图象中的t3时为升高温度,t1时加压正向移动,氨气的含量增大,t3时为升高温度,化学平衡逆向移动,氨气的含量降低,即t2-t3一段时间平衡混合物中NH3的含量最高;故答案为:加压; t2-t3.
点评:本题以元素的推断为载体,考查了元素化合物知识,注重了高考的热点,有利于学生巩固基础知识和基本技能.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在4份碘化钾淀粉溶液中,分别加入下列物质,不能使溶液变蓝的是( )
| A、氯化氢 | B、溴水 |
| C、氯气 | D、碘的酒精溶液 |
下列说法或表示不正确的是( )
| A、氯乙烯可通过加聚反应生成高分子化合物 |
| B、CaC2,MgCl2,Na2O2中都含有共价键 |
| C、由水电离出的e(H+)=1.0*10-5mol?L-1的溶液中,可能含有Fe3+,NH4+,MnO4-,SO42- |
| D、若只已知某物质的实验式为C2H5,仍确定其化学式 |
可逆反应N2(g)+3H2(g)?2NH3(g),△H=-Q KJ/mol(Q>0).有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知Q1=4Q2.下列叙述不正确的是( )
| A、达到平衡时,两容器中反应物的转化率不同 |
| B、达到平衡时,甲中NH3的体积分数与乙相等 |
| C、达到平衡后,再向乙中加入0.2moLN2、0.6molH2、1.6molNH3,平衡向生成NH3的方向移动 |
| D、乙中的热化学反应方程式为2NH3(g)?N2(g)+3H2(g);△H=+Q2KJ/mol |
已知:CaCO3(s)?CaO(s)+CO2(g)△H>0,△S>0,则该反应能自发进行的条件是( )
| A、低温 |
| B、高温 |
| C、任何温度下都能自发进行 |
| D、任何温度下都不能自发进行 |
下列反应不可能是原电池反应的是( )
| A、Fe+2H+=Fe2++H2↑ |
| B、H++OH-=H2O |
| C、2H2+O2=2H2O |
| D、Fe2++Zn=Fe+Cu2+ |
W,X,Y,Z是周期表中四种短周期元素,原子序数依次增大,W,X和Y,Z分别同周期,X,Y同主族,W的气态氢化物可以与最高价含氧酸反应生成离子化合物,由此可知:( )
| A、X,Y,Z中最简单氢化物稳定性最弱的是Y |
| B、Z元素氧化物对应水化物的酸性一定强于Y元素氧化物对应水化物的酸性 |
| C、X2-的还原性大于Y2- |
| D、Z元素单质在化学反应中只表现出氧化性 |
化学与生活,社会密切相关.下列说法正确的是( )
| A、绿色化学的核心是应用化学原理对环境污染进行治理 |
| B、春节是我国传统的节日,应把“爆竹声声辞旧岁,总把新桃换旧符”发扬光大 |
| C、近期H7N9型禽流感又在蔓延,应少吃熟的家禽食品 |
| D、“雾霾天气”“温室效应”“光化学烟雾”“PM2.5”等都与汽车尾气排放有关 |
 如图表示一个精炼粗铜的电解池,电解液a选用CuSO4溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个精炼粗铜的电解池,电解液a选用CuSO4溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: