题目内容
8.下列金属防腐的措施中,属于牺牲阳极的阴极保护法的是( )| A. | 水中的钢闸门连接电源的负极 | |
| B. | 地下钢管连接锌板 | |
| C. | 铁件镀铜 | |
| D. | 自行车的钢圈和车铃上镀上一层铬,既耐腐蚀又美观耐磨 |
分析 金属防腐的措施中,使用牺牲阳极的阴极保护法,说明该装置构成原电池,被保护的金属作正极,据此分析解答.
解答 解:金属防腐的措施中,使用牺牲阳极的阴极保护法,说明该装置构成原电池,被保护的金属作正极,
A.水中的钢闸门连接电源的负极,Fe作电解池的阴极,属于外加电源的阴极保护法,故A错误;
B.地下钢管连接锌块,Fe、锌、电解质溶液构成原电池,Fe失电子能力小于锌而作正极被保护,所以该保护方法属于牺牲阳极的阴极保护法,故B正确;
C.铁件镀铜,阻止Fe与空气、水接触,从而防止金属被腐蚀,故C错误;
D.自行车的钢圈和车铃上镀上一层铬,阻止Fe与空气、水接触,从而防止金属被腐蚀,故D错误.
故选B.
点评 本题考查了金属的腐蚀与防护,侧重考查基础知识与基本能力,明确原电池原理即可解答,题目难度不大.

练习册系列答案
相关题目
18.某有机化合物的结构简式为: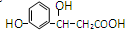 ,它可以发生反应的类型有①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚,其中组合完全且正确的是( )
,它可以发生反应的类型有①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚,其中组合完全且正确的是( )
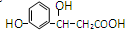 ,它可以发生反应的类型有①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚,其中组合完全且正确的是( )
,它可以发生反应的类型有①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚,其中组合完全且正确的是( )| A. | ①②③④ | B. | ①②④⑤ | C. | ①②⑤⑥ | D. | ①②③④⑤ |
16.下列有关说法不正确的( )
| A. | 无单质参加的化合反应有可能是氧化还原反应 | |
| B. | Al既能溶于强酸,又能溶于强碱,所以说明“Al既有金属性,又有非金属性” | |
| C. | 青铜是人类在生产生活中使用最早的合金 | |
| D. | 硅在自然界中只以化合态形式存在 |
3.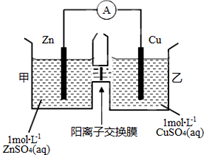 锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过.下列有关叙述不正确的是( )
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过.下列有关叙述不正确的是( )
 锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过.下列有关叙述不正确的是( )
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过.下列有关叙述不正确的是( )| A. | Zn电极上发生氧化反应 | |
| B. | 电子的流向为Zn→电流表→Cu | |
| C. | SO42-由乙池通过离子交换膜向甲池移动 | |
| D. | 电池工作一段时间后,乙池溶液的总质量明显增加 |
20.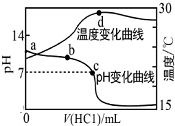 室温下,向a点(pH=a)的20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )
室温下,向a点(pH=a)的20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )
 室温下,向a点(pH=a)的20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )
室温下,向a点(pH=a)的20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )| A. | 将此氨水稀释,溶液的导电能力减弱 | |
| B. | b点溶液中离子浓度大小可能存在:c(NH${\;}_{4}^{+}$)>c(Cl-)>c(OH-)>c(H+) | |
| C. | c点时消耗盐酸体积V(HCl)<20.00mL | |
| D. | a、d两点的溶液,水的离子积Kw(a)>Kw(d) |
17.下列关于乙醇(C2H5OH)的描述错误的是( )
| A. | 俗称酒精 | B. | 不能与金属钠反应 | ||
| C. | 乙醇可用于消毒 | D. | 能与乙酸发生酯化反应 |
14.下列反应的离子方程式正确的是( )
| A. | 乙醛溶液与新制氢氧化铜悬浊液共热CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+2H2O | |
| B. | 甲酸溶液与新制氢氧化铜反应:2H++Cu(OH)2→Cu2++2H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳: +CO2+H2O$\stackrel{△}{→}$ +CO2+H2O$\stackrel{△}{→}$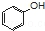 +HCO3- +HCO3- | |
| D. | 乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+OH-→CH3COO-+CH3CH2O-+H2O |