��Ŀ����
����Ŀ����ѧ��Ӧ�����ǻ�ѧ��Ӧԭ������Ҫ��ɲ��֡���ش��������⣺
��1����֪һ�������·�����Ӧ��2SO2��g��+O2��g��![]() 2SO3��g����H��0���ڷ�Ӧ�����У�����Ӧ���ʵı仯��ͼ��ʾ����������ʵı仯�ش��ȡ�Ĵ�ʩ���ı����������
2SO3��g����H��0���ڷ�Ӧ�����У�����Ӧ���ʵı仯��ͼ��ʾ����������ʵı仯�ش��ȡ�Ĵ�ʩ���ı����������
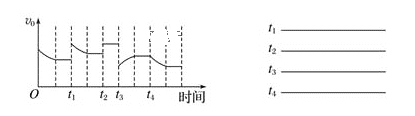
_______��________��_______��______
��2��̽����Ӧ������0.l0 mol��L-1Na2S2O3��Һ��ϡH2SO4��Ӧ���ʵ�Ӱ�졣�������ⶨ��������
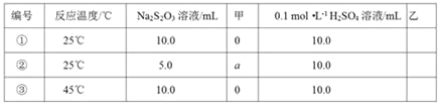
����ʵ��٢���̽��____�Ի�ѧ��Ӧ���ʵ�Ӱ�죻������ʵ��٢���̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬�������������Ϊ____��aΪ____������ʵ����Ҫ���������������������������Ϊ____��
��3����֪2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2�����ڿ�ʼһ��ʱ���ڣ���Ӧ���ʽ�С����Һ��ɫ�����ԣ�������ͻȻ��ɫ����Ӧ������������
�������������ijͬѧ��Ϊ�÷�Ӧ���ȣ�������Һ�¶���������Ӧ��������Ӱ�컯ѧ��Ӧ���ʵ����ؿ�������뻹������___��Ӱ�졣
������ʵ��֤����IJ��룬�����Ը��������Һ��������Һ�⣬�����ڷ�Ӧһ��ʼʱ����____������ĸ����
A������� B���Ȼ��� C�������� D��ˮ
���𰸡���ѹ������Ӧ��Ũ�� ������� ��ѹ���С��Ӧ��Ũ�� ��С������Ũ�� �¶� V������ˮ��/mL 5.0 ���ֻ��ǵ�ʱ��/min �������������ӵĴ����ã� C
��������
��1��2SO2��g��+O2��g��2SO3��g����H��0���÷�Ӧ��һ�����������С������Ӧ�Ƿ��ȵĻ�ѧ��Ӧ��
t1ʱ����Ӧ����������ƽ��ʱ��Ӧ����С��t1ʱ��Ӧ���ʣ���ƽ��������Ӧ�����ƶ����ı������Ϊ��ѹ������Ӧ��Ũ�ȣ�
t2ʱ����Ӧ��������ƽ�ⲻ�ƶ����ı������Ϊ���������
t3ʱ����Ӧ���ʼ�С����ƽ��ʱ��Ӧ���ʴ���t3ʱ��Ӧ���ʣ���ƽ�����淴Ӧ�����ƶ����ı������Ϊ��ѹ���С��Ӧ��Ũ�ȣ�
t4ʱ����Ӧ���ʲ��䣬��ƽ��ʱ��Ӧ����С��t4ʱ��Ӧ���ʣ���ƽ��������Ӧ�����ƶ����ı������Ϊ��С������Ũ�ȣ�
��2����̽��ijһ�����ضԷ�Ӧ���ʵ�Ӱ��ʱ�����뱣������Ӱ������һ�£�ͨ���Ƚ�ʵ��٢۵ķ�Ӧ������֪��ʵ��٢ۿ�̽���¶ȶԷ�Ӧ���ʵ�Ӱ�죻ʵ��٢��е�Na2S2O3��Һ�ļ��������ͬ����Ҫ̽��Na2S2O3��ҺŨ�Ȳ�ͬ�Է�Ӧ���ʵ�Ӱ�죬����Ӧ�����Һ�����������ͬ����Ӧ��������ˮ��ȷ����Һ���������ͬ���ʼ�ӦΪV������ˮ��/mL��a��ֵΪ5.0����Na2S2O3��Һ��ϡH2SO4��Ӧ���ɶ�����������������Ҫȷ������Ӧ���ʵĿ���������ȷ�����Һ���ֻ���ʱ��ij��̣�����Ҫ�������������dz��ֻ��ǵ�ʱ��/min���ʴ�Ϊ���¶ȣ�V������ˮ��/mL��5.0�����ֻ��ǵ�ʱ��/min��
��3����KMnO4��H2C2O4��Ӧ���������̣��������д����ã����Բ��뻹�����Ǵ��������ã�
�ڷ�Ӧ����ʽ2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2���У�Ũ�ȱ仯�ϴ��Ϊ�����ӣ�����ѡ�����������Լ�Ӧ�ú��������ӣ�����B�����Ȼ�����Ҳ��Mn2+��ȴ����ѡΪ������ԭ����������е�Cl���ױ����Ը��������Һ��������ֻ��C��ȷ��

 ѧϰʵ����ϵ�д�
ѧϰʵ����ϵ�д�