题目内容
【题目】NaHSO3可被过量KIO3氧化,当NaHSO3完全消耗时即有I2析出。某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素。
(1)写出NaHSO3溶液与过量KIO3溶液反应生成I2的离子方程式:____________。
(2)调节反应物浓度和温度进行对比实验,记录结果如下:
编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
① | 10 | 15 | a | 10 | t1 |
② | 10 | 40 | 0 | 10 | t2 |
③ | 10 | b | 0 | 20 | t3 |
表中a=________,b=________。
(3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(“×××”表示超过50℃后溶液不会再变蓝)。
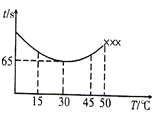
①在30℃下,若溶液变蓝时,I2的物质的量为n mol,则从反应开始至溶液变蓝,IO3-的平均反应速率______mol·L-1·s-1(写出表达式即可,不要化简)。
②根据图像,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系:____。
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二:
假设一:反应生成的I2对反应起催化作用;
假设二:_________________________________________;
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定):____。
实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
【答案】2IO3+5HSO3=5SO42+I2+3H++H2O 25 40 2n/(50×10-3×65) 温度低于30℃时,温度越高,溶液变蓝所需时间越短;温度高于30℃时,温度越高,溶液变蓝所需时间越长 反应生成的H+对反应起催化作用,H+浓度越大反应速率越快;或反应生成的SO42对反应起催化作用,SO42浓度越大反应速率越快;或该反应是放热反应,温度升高导致反应速率加快
实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
在烧杯甲中将NaHSO3溶液与过量KIO3溶液混合,用测速仪测定起始时的反应速率v(甲);在烧杯乙中进行同一反应(不同的是乙烧杯中预先加入少量I2,其它反应条件均完全相同),测定其起始阶段的相同时间内的反应速率v(乙) | 若v(甲)=v(乙),则假设一不成立;若v(甲)<v(乙),则假设一成立。 |
【解析】
(1)NaHSO3溶液与过量KIO3溶液反应生成I2,根据氧化还原反应原理和元素守恒,IO3与HSO3反应生成SO42、I2、H+和H2O,则离子方程式为:2IO3+5HSO3=5SO42+I2+3H++H2O。
(2)为了使这3组实验具有可比性,根据控制变量法可知溶液的体积应相等,所以a=25mL;b=40mL。
(3)①根据图像,从反应开始至溶液变蓝需要的时间为65s,溶液变蓝时,I2的物质的量为n mol,则消耗IO3-物质的量为2n mol,根据表中数据溶液的体积为50mL,则v(IO3)=2n/(50×10-3×65)mol·L-1·s-1。
②根据图像可以看出,30℃时溶液变蓝所需时间最少,温度低于30℃时,温度越高,溶液变蓝所需时间越短;温度高于30℃时,温度越高,溶液变蓝所需时间越长。
(4)该反应除了生成I2,还生成了SO42和H+,则假设二起催化作用的可能为H+或SO42,也可以从温度升高等方面提出假设。
(5)假设一为反应生成的I2对反应起催化作用,所以验证实验为对比实验,一个烧杯将NaHSO3溶液与过量KIO3溶液混合,用测速仪测定起始时的反应速率v(甲);另一烧杯预先加入少量I2,其它反应条件均完全相同,通过对比二者反应速率进行检验。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案【题目】I.利用如图所示装置测定中和热的实验步骤如下:
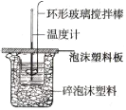
①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,使之混合均匀,测得混合溶液最高温度。
回答下列问题:
(1)所用NaOH溶液要稍过量,理由是__。
(2)环形玻璃搅拌棒搅拌溶液的操作是__。
(3)___(填“能”或“不能”)用Ba(OH)2溶液和H2SO4溶液代替NaOH溶液和盐酸,理由__。
(4)现将一定量的稀NaOH溶液、Ca(OH)2溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔΗ1、ΔΗ2、ΔΗ3,则ΔΗ1、ΔΗ2、ΔΗ3的大小关系为___。
II.实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制250mL0.1000mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2–3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作4次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,消耗NaOH溶液的体(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 20.02 | 20.00 |
2 | 0.10 | 20.00 | 20.00 |
3 | 0.10 | 19.00 | 20.00 |
4 | 0.10 | 19.98 | 20.00 |
(1)步骤一需要称量氢氧化钠固体的质量为___g,配制标准溶液需要用到玻璃棒,烧杯外,还需要的玻璃仪器有___。
(2)根据上述数据,可计算出该盐酸的浓度为___(保留小数点后2位)。
(3)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有__。
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
III.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1)配平离子方程式:__MnO4-+__HSO3-+__H+=__
(2)用KMnO4进行滴定时,KMnO4溶液应装在___滴定管中(填酸式或碱式),判断滴定终点的现象是:滴入最后一滴KMnO4溶液时,___。






