题目内容
18.按照要求回答下列问题:A、B、C、D、E是常见化合物或单质,有如下转化关系 (略去条件和副产品).
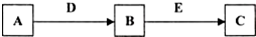
若A为黄绿色气体单质,D、E为生活中常见的两种金属,其中E是一种红色光亮的物质.
(1)写出向B的溶液中加入足量D的离子反应方程式Fe+2Fe3+═3Fe2+.
(2)向(1)所得的溶液中加入NaOH溶液,并在空气中放置的现象是:生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色,写出所得固体在空气中放置时发生的化学反应方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
分析 若A为黄绿色气体单质,则A为Cl2,D、E为生活中常见的两种金属,其中E是一种红色光亮的物质,则E为Cu,根据转化关系,D为Fe,B为FeCl3,FeCl3与Cu反应得FeCl2和CuCl2.
解答 解:若A为黄绿色气体单质,则A为Cl2,D、E为生活中常见的两种金属,其中E是一种红色光亮的物质,则E为Cu,根据转化关系,D为Fe,B为FeCl3,FeCl3与Cu反应得FeCl2和CuCl2.
(1)向B的溶液中加入足量D的离子反应方程式:Fe+2Fe3+═3Fe2+,
故答案为:Fe+2Fe3+═3Fe2+;
(2)向FeCl2溶液中加入NaOH溶液,可得Fe(OH)2白色沉淀,在空气中能被氧化成红褐色氢氧化铁沉淀,其化学反应方程式是:4Fe(OH)2+O2+2H2O=4Fe(OH)3,现象为:生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色,
故答案为:生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查无机物推断,“物质的颜色、生活中常见金属”是推断突破口,熟练掌握元素化合物性质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列实验方法能达到目的是( )
| A. | 用焰色反应鉴別Na2CO3溶液和K2CO3溶液 | |
| B. | 用分液漏斗分离食醋中的乙酸与水 | |
| C. | 用丁达尔现象检验NaCl溶液中是否含有淀粉胶体 | |
| D. | 用NaOH溶液除去Cl2中混有的少量HCl |
9.下列物质中既能跟酸反应,又能跟碱溶液反应的是( )
①NaHCO3 ②SiO2 ③Al(OH)3 ④Al.
①NaHCO3 ②SiO2 ③Al(OH)3 ④Al.
| A. | 全部 | B. | ①③④ | C. | ②③④ | D. | ③④ |
10.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA | |
| B. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| C. | 常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| D. | 某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 滴加石蕊溶液显蓝色的溶液:Na+、Fe3+、HCO3-、NO3- | |
| B. | 0.1 mol•L-1 AgNO3溶液:H+、K+、SO42-、I- | |
| C. | 0.1 mol•L-1 AlCl3溶液:Mg2+、K+、SO42-、NO3- | |
| D. | 0.1 mol•L-1 NaAlO2溶液:H+、Na+、Cl-、SO42- |
10.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色.
(1)B元素在元素周期表中的位置第三周期ⅢA族.
B形成的简单离子的结构示意图 .
.
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(3)用电子式表示C、H形成化合物的过程: .
.
用电子式表示G、E形成最高价化合物的过程: .
.
(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键、共价键.
F、E形成原子个数比为1:1的化合物的电子式 .
.
(5)F与G形成10电子的化合物的结构式 .
.
(6)A、B、C、E形成的简单离子的半径由大到小的顺序为S2->O2->Mg2+>Al3+(填离子符号).
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)B元素在元素周期表中的位置第三周期ⅢA族.
B形成的简单离子的结构示意图
 .
.(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(3)用电子式表示C、H形成化合物的过程:
 .
.用电子式表示G、E形成最高价化合物的过程:
 .
.(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键、共价键.
F、E形成原子个数比为1:1的化合物的电子式
 .
.(5)F与G形成10电子的化合物的结构式
 .
.(6)A、B、C、E形成的简单离子的半径由大到小的顺序为S2->O2->Mg2+>Al3+(填离子符号).

 .反应①的反应类型是水解反应.
.反应①的反应类型是水解反应. .
.