题目内容
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4.1molA单质跟盐酸反应可置换出11.2L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子.试回答:
(1)A是
(2)写出A元素的单质在氧气燃烧时生成物的电子式: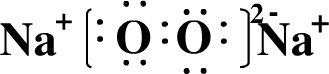
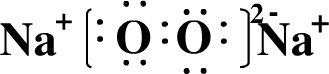 .
.
(3)写出由A元素和C元素组成化合物的形成过程:
 .
.
(4)分别写出A、B最高价氧化物对应水化物分别跟C的气态氢化物水溶液反应的离子方程式:
(5)A离子的氧化性比B离子的氧化性
(1)A是
Na
Na
元素,B是Al
Al
元素,C是Cl
Cl
元素.(2)写出A元素的单质在氧气燃烧时生成物的电子式:
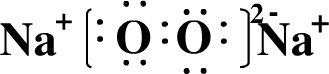
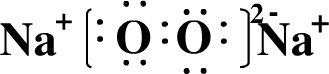
(3)写出由A元素和C元素组成化合物的形成过程:


(4)分别写出A、B最高价氧化物对应水化物分别跟C的气态氢化物水溶液反应的离子方程式:
OH-+H+═H2O、Al(OH)3+3H+═Al3++3H2O
OH-+H+═H2O、Al(OH)3+3H+═Al3++3H2O
.(5)A离子的氧化性比B离子的氧化性
弱
弱
,这是由于A单质的还原性强或A元素的金属性强
A单质的还原性强或A元素的金属性强
.分析:A、B、C三种元素的原子具有相同的电子层数,则在同一周期,1molA单质跟盐酸反应可置换出11.2L(标准状况下)氢气,设A的化合价为x,
由电子守恒可知,1mol×x=
×2×1,解得x=1,即A的最外层电子数为1,又A转变成与氖原子具有相同电子层结构的离子,则A为Na,
再根据B的核电荷数比A大2,B为Al,C原子的电子总数比B原子电子总数多4,C为Cl,然后利用单质、化合物的性质来解答.
由电子守恒可知,1mol×x=
| 11.2L |
| 22.4L/mol |
再根据B的核电荷数比A大2,B为Al,C原子的电子总数比B原子电子总数多4,C为Cl,然后利用单质、化合物的性质来解答.
解答:解:A、B、C三种元素的原子具有相同的电子层数,则在同一周期,1molA单质跟盐酸反应可置换出11.2L(标准状况下)氢气,设A的化合价为x,
由电子守恒可知,1mol×x=
×2×1,解得x=1,即A的最外层电子数为1,又A转变成与氖原子具有相同电子层结构的离子,则A为Na,
再根据B的核电荷数比A大2,B为Al,C原子的电子总数比B原子电子总数多4,C为Cl,
(1)由上述推导可知,A为Na,B为Al,C为Cl,故答案为:Na;Al;Cl;
(2)Na在氧气中燃烧生成过氧化钠,其电子式为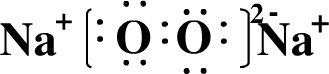 ,故答案为:
,故答案为: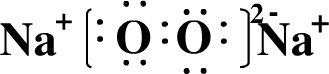 ;
;
(3)A元素和C元素组成化合物为NaCl,为离子化合物,其形成过程为 ,
,
故答案为: ;
;
(4)A、B最高价氧化物对应水化物分别为NaOH、Al(OH)3,C的气态氢化物为HCl,分别反应的离子反应为OH-+H+═H2O、Al(OH)3+3H+═Al3++3H2O,
故答案为:OH-+H+═H2O、Al(OH)3+3H+═Al3++3H2O;
(5)金属性Na>Al,还原性Na>Al,则A离子的氧化性比B离子的氧化性弱,故答案为:弱;A单质的还原性强或A元素的金属性强.
由电子守恒可知,1mol×x=
| 11.2L |
| 22.4L/mol |
再根据B的核电荷数比A大2,B为Al,C原子的电子总数比B原子电子总数多4,C为Cl,
(1)由上述推导可知,A为Na,B为Al,C为Cl,故答案为:Na;Al;Cl;
(2)Na在氧气中燃烧生成过氧化钠,其电子式为
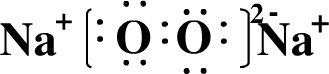 ,故答案为:
,故答案为: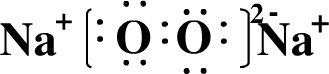 ;
; (3)A元素和C元素组成化合物为NaCl,为离子化合物,其形成过程为
 ,
,故答案为:
 ;
;(4)A、B最高价氧化物对应水化物分别为NaOH、Al(OH)3,C的气态氢化物为HCl,分别反应的离子反应为OH-+H+═H2O、Al(OH)3+3H+═Al3++3H2O,
故答案为:OH-+H+═H2O、Al(OH)3+3H+═Al3++3H2O;
(5)金属性Na>Al,还原性Na>Al,则A离子的氧化性比B离子的氧化性弱,故答案为:弱;A单质的还原性强或A元素的金属性强.
点评:本题考查原子结构与元素周期律,A元素的推断是解答本题的突破口,注意利用电子守恒来计算A的化合价,并熟悉元素及其单质、化合物的性质来解答.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目

 如图是周期表中短周期的一部分,A.B.C三种元素的原子核外电子数之和等于B的质子数的2倍.(用元素符号表示)
如图是周期表中短周期的一部分,A.B.C三种元素的原子核外电子数之和等于B的质子数的2倍.(用元素符号表示)