题目内容
H2O2是一种绿色氧化剂和还原剂,在化学研究中应用广泛.某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.
限选试剂与仪器:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、
量筒、秒表、恒温水浴槽、注射器
(1)写出本实验H2O2分解反应方程式,并标明电子转移的方向和数目: .
(2)设计实验方案:
在不同H2O2浓度下,测定 (要求所测得的数据能直接体现反应速率大小).
(3)设计实验装置,完成下图虚线框中的装置示意图.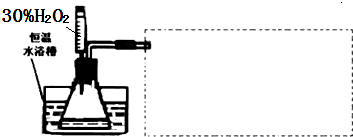
(4)某同学拟定下列实验表格,完整体现实验方案,请你将表格中实验2所缺数据补充完整.
(任补一组,只要合理即可.)
(5)做实验时某同学由于粗心误将FeSO4溶液当成了Fe2(SO4)3溶液加入锥形瓶中,你认为他能快速得到O2完成这个实验吗? ,请结合离子方程式说明理由 .
限选试剂与仪器:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、
量筒、秒表、恒温水浴槽、注射器
(1)写出本实验H2O2分解反应方程式,并标明电子转移的方向和数目:
(2)设计实验方案:
在不同H2O2浓度下,测定
(3)设计实验装置,完成下图虚线框中的装置示意图.

(4)某同学拟定下列实验表格,完整体现实验方案,请你将表格中实验2所缺数据补充完整.
(任补一组,只要合理即可.)
| 实验序号 | V[Fe2(SO4)3]/mL | V(H2O2)/mL | V(蒸馏水)/mL | 时间t/min | V(氧气)/mL |
| 1 | 1.0 | 10.0 | 5.0 | 2.0 | 10.0 |
| 2 | 2.0 |
考点:浓度、温度、催化剂对化学反应速率的影响
专题:
分析:(1)过氧化氢在硫酸铁作催化剂条件下分解生成水与氧气,反应中过氧化氢既作氧化剂又做还原剂;
(2)反应速率表示单位时间内物质的量浓度变化量,测定不同浓度的过氧化氢对反应速率的影响,需要测定相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少;
(3)氧气难溶于水,故利用排水法收集,画出图即可;
(4)催化剂不变,只改变反应物的浓度即可,缩小或扩大,浓度缩小,则生成气体体积相应减小相同的倍数;
(5)利用双氧水具有强氧化性回答即可.
(2)反应速率表示单位时间内物质的量浓度变化量,测定不同浓度的过氧化氢对反应速率的影响,需要测定相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少;
(3)氧气难溶于水,故利用排水法收集,画出图即可;
(4)催化剂不变,只改变反应物的浓度即可,缩小或扩大,浓度缩小,则生成气体体积相应减小相同的倍数;
(5)利用双氧水具有强氧化性回答即可.
解答:
解:解:(1)过氧化氢在硫酸铁作催化剂条件下分解生成水与氧气,反应中过氧化氢既作氧化剂又做还原剂,标出电子转移数目及方向为: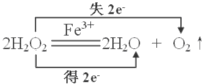 ,
,
故答案为: ;
;
(2)反应速率表示单位时间内物质的量浓度变化量,测定不同浓度的过氧化氢对反应速率的影响,需要测定相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少,
故答案为:相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少;
(3)氧气难溶于水,故可以采用排水法收集,为 ,
,
故答案为: ;
;
(4)催化剂不变,只改变反应物的浓度,缩小或扩大,浓度缩小,则生成气体体积相应减小相同的倍数;本解答以缩小双氧水的浓度为例,即加入双氧水5.0mL,加入水体积为10.0mL,则生成氧气体积为5.0mL,故答案为:
;
(5)由于双氧水具有强氧化性,故能将亚铁离子氧化为铁离子,反应的离子反应方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:能;因H2O2有较强的氧化性,能将Fe2+氧化成Fe3+,同样可以起到催化作用.
H2O2+2Fe2++2H+=2Fe3++2H2O.
 ,
,故答案为:
 ;
;(2)反应速率表示单位时间内物质的量浓度变化量,测定不同浓度的过氧化氢对反应速率的影响,需要测定相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少,
故答案为:相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少;
(3)氧气难溶于水,故可以采用排水法收集,为
 ,
,故答案为:
 ;
;(4)催化剂不变,只改变反应物的浓度,缩小或扩大,浓度缩小,则生成气体体积相应减小相同的倍数;本解答以缩小双氧水的浓度为例,即加入双氧水5.0mL,加入水体积为10.0mL,则生成氧气体积为5.0mL,故答案为:
| 实验序号 | V[Fe2(SO4)3]/mL | V(H2O2)/mL | V(蒸馏水)/mL | 时间t/min | V(氧气)/mL |
| 1 | 1.0 | 10.0 | 5.0 | 2.0 | 10.0 |
| 2 | 1.0 | 5.0 | 10.0 | 2.0 | 5.0 |
(5)由于双氧水具有强氧化性,故能将亚铁离子氧化为铁离子,反应的离子反应方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:能;因H2O2有较强的氧化性,能将Fe2+氧化成Fe3+,同样可以起到催化作用.
H2O2+2Fe2++2H+=2Fe3++2H2O.
点评:本题主要考查的是实验室中利用双氧水制取氧气中,外界条件对化学反应速率的影响,属于常考题.

练习册系列答案
相关题目
某溶液中存在大量的H+、SO42-、Cl-,该溶液中还可能大量存在的离子是( )
| A、OH- |
| B、Na+ |
| C、Ag+ |
| D、Ba2+ |
日本福岛第一核电站泄漏出微量的钚(Pu)-239.下列关于
Pu叙述准确的是( )
239 94 |
| A、原子序数是239 |
| B、质量数是94 |
| C、中子数是239 |
| D、质子数是94 |
只用一种试剂可以区别Na2SO4、MgCl2、FeCl2、FeCl3、Al2(SO4)3、(NH4)2SO4六种溶液,这种试剂是( )
| A、Ba(OH)2 |
| B、NaOH |
| C、H2S |
| D、AgNO3 |
食品包装袋中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )
| A、脱氧过程是吸热反应映,可降低温度,延长糕点保质期 |
| B、脱氧过程中铁作原电池负极,电极反应为:Fe-3e-═Fe3+ |
| C、脱氧过程中碳做原电池正极,电极反应为:O2+4 e-+4H+═2H2O |
| D、含有2.24g铁粉的脱氧剂,理论上最多能吸收氧气672 mL(标准状况) |
元素及其化合物丰富了物质世界,下列说法正确的是( )
| A、常温下铁在冷的浓硫酸中会钝化,所以常温下铁与浓硫酸不反应 |
| B、稀Na2CO3溶液和稀H2SO4溶液相互滴加的现象相同,而氨水与FeCl3溶液相互滴加现象不同 |
| C、金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 |
| D、工业上常用石灰乳和氯气来制备漂白粉,漂白粉的有效成份是Ca(ClO)2 |
 某同学用图示装置进行铁和稀硝酸反应的实验并进行相关的实验探究.
某同学用图示装置进行铁和稀硝酸反应的实验并进行相关的实验探究. 地球是一个巨大的生态系统,森林对保护改善人类的生存环境有着十分重要的作用.科学实验证明,1公顷柳杉林每月可以吸收SO2160kg,试解答下列问题:
地球是一个巨大的生态系统,森林对保护改善人类的生存环境有着十分重要的作用.科学实验证明,1公顷柳杉林每月可以吸收SO2160kg,试解答下列问题: