题目内容
配制500mL 1.0mol/L的NaCl溶液时,下列操作会使实际浓度偏高,偏低还是不变,请填空:
(1)摇匀后,液面低于刻度线,没有再加水;
(2)移液过程中,不小心溅出少量溶液;
(3)定容时,俯视刻度线; .
(1)摇匀后,液面低于刻度线,没有再加水;
(2)移液过程中,不小心溅出少量溶液;
(3)定容时,俯视刻度线;
考点:配制一定物质的量浓度的溶液
专题:
分析:分析不当操作对溶质的物质的量和溶液体积的影响,依据C=
进行误差分析.
| n |
| V |
解答:
解:(1)摇匀后,液面低于刻度线,没有再加水,操作正确,溶液浓度不变,
故答案为:不变;
(2)移液过程中,不小心溅出少量溶液,导致溶质的物质的量n偏小,溶液的浓度偏低,
故答案为:偏低;
(3)定容时,俯视刻度线,导致溶液的体积偏小,溶液的浓度偏高,
故答案为:偏高.
故答案为:不变;
(2)移液过程中,不小心溅出少量溶液,导致溶质的物质的量n偏小,溶液的浓度偏低,
故答案为:偏低;
(3)定容时,俯视刻度线,导致溶液的体积偏小,溶液的浓度偏高,
故答案为:偏高.
点评:本题考查了配制一定物质的量浓度溶液误差分析,依据C=
,分析不当操作对溶质的物质的量和溶液的体积的影响即可分析,题目难度不大,注意对基础知识的积累.
| n |
| V |

练习册系列答案
相关题目
下列各组物质的溶液中,在可加热的条件下仅依靠物质间相互反应不能一一区别的一组是( )
| A、KHSO4、Na2CO3、(NH4)2SO4、FeCl3 |
| B、K2CO3、MgCl2、Al2(SO4)3、KOH |
| C、NaCl、KCl、CuCl2、AgNO3 |
| D、NaOH、(NH4)2SO4、Na2SO4、BaCl2 |
下列四组实验,根据实验事实得出的结论,正确的是( )
| A、在某试液中滴加BaCl2溶液得白色沉淀,取该白色沉淀加稀硝酸不溶解--原未知试液中一定含有SO42- |
| B、某未知气体在空气中燃烧,其产物能使无水CuSO4变蓝色-原气体一定是H2 |
| C、在某未知试液中滴加盐酸产生无色气体,将该气体通入足量澄清石灰水中得白色沉淀--原未知试液中一定含有CO32- |
| D、在某未知试液中加入浓的NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体--原未知试液中一定含有NH4+ |
在恒温、恒容的容器中进行反应:2HI?H2+I2(正反应为吸热反应),反应物的浓度由0.1mol/L降到0.06mol/L需要20s,那么由0.06mol/L降到0.036mol/L所需时间为( )
| A、等于10 s |
| B、等于12 s |
| C、大于12 s |
| D、小于12 s |
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)△H=a kJ?mol-1其化学平衡常数K和温度t的关系如下表:下列说法中正确的是( )
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A、该反应的正反应为放热反应,即a<0 |
| B、当平衡浓度符合c(CO2)?c(H2)=c(CO)?c(H2O)时的温度为830℃ |
| C、当其他条件不变时,若缩小容器的体积,则有利于该反应平衡正向移动 |
| D、当v(H2)=v(H2O)时该反应达到化学平衡状态 |
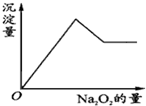 有一透明溶液,可能含有Al3+、Fe3+、K+、NH4+、Mg2+和Cu2+等离子中的一种或几种.现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀.加入Na2O2的量与生成白色沉淀的量之间的关系如图:
有一透明溶液,可能含有Al3+、Fe3+、K+、NH4+、Mg2+和Cu2+等离子中的一种或几种.现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀.加入Na2O2的量与生成白色沉淀的量之间的关系如图: