题目内容
5. 甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇.
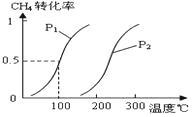
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇.(1)将1.0mol CH4和2.0mol H2O(g)通入容积为10L的反应室,在一定条件下发生反应Ⅰ:CH4(g)+H2O(g)?CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图:
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.030mol•L-1•min-1.
②在其它条件不变的情况下升高温度,化学平衡常数将增大(填“增大”“减小”或“不变”).
③图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-2.
④保持反应体系为100℃,5min后再向容器中冲入H2O、H2各0.5mol,化学平衡将向向左移动(填“向左”“向右”或“不”).
(2)在压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发发生反应Ⅱ:
CO(g)+2H2(g)?CH3OH(g)
①该反应的△H<0,△S<0(填“<”、“>”或“=”).
②若容器容积不变,下列措施可以提高CO转化率的是BD.
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2.
分析 (1)①根据图知道平衡时甲烷的转化率,求出△c(CH4),根据v=$\frac{△c}{△t}$计算v(CH4),利用速率之比等于化学计量数之比计算v(H2);
②转化率与温度、压强图象有三个变量,应“定一议二”;
③根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时甲烷的转化率,由此判断;平衡常数k=$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})•c({H}_{2}O)}$,计算出平衡时各组分的浓度,代入平衡常数表达式计算;
④保持反应体系为100℃,5min后再向容器中冲入H2O、H2各0.5mol,根据浓度商与平衡常数的相对大小的判断;
(2)①混合气体在催化剂作用下能自发反应生成甲醇,则说明正反应是放热反应,正反应是气体物质的量减小的反应;
②容器容积不变,增加甲醇产率,平衡向正反应移动,根据外界条件对平衡的影响分析.
解答 解:(1)①由100℃平衡CH4的转化率为0.5可知,消耗CH4为1mol×0.5=0.5mol,平衡时甲烷的浓度变化量为:$\frac{0.5}{10}$=5×10-2mol/L,根据甲烷与氢气的计量数关系,则:v(H2)=3v(CH4)=3×$\frac{5×1{0}^{-2}}{5min}$=0.030mol•L-1•min-1,
故答案为:0.030mol•L-1•min-1;
②通过图表可知当温度相同时,p2→p1时,甲烷的转化率提高,平衡向正向移动,正向为气体系数增大的反应,根据减小压强平衡向系数增大的方向移动可得出p1<p2;当压强为p1时,升高温度,甲烷的转化率提高,平衡向正向移动,所以正向为吸热反应,所以升高温度平衡常数变大,故答案为:增大;
③由图可知温度相同时,到达平衡时,压强为P1的CH4转化率高,正反应为气体体积增大的反应,增大压强平衡向逆反应方向移动,甲烷的转化率降低,故压强P1<P2,
CH4(g)+H2O(g)=CO(g)+3H2(g)
初始浓度:0.1 0.2 0 0
变化浓度:0.05 0.05 0.05 0.15
平衡浓度:0.05 0.15 0.05 0.15
100℃时平衡常数=$\frac{0.05×(0.15)^{3}}{0.05×0.15}$(mol/L)2=2.25×10-2 (mol/L)2,
故答案为:<;2.25×10-2;
④保持反应体系为100℃,5min后再向容器中冲入H2O、H2各0.5mol,Qc=$\frac{0.05×(0.2)^{3}}{0.05×0.2}$=4×10-2>K,所以平衡向左移动,故答案为:向左;
(2)①混合气体在催化剂作用下能自发反应生成甲醇,则说明正反应是放热反应,所以△H<0;正反应是气体物质的量减小的反应,气体的物质的量越多,其熵越大,所以△S<0,故答案为:<;<;
②A.该反应为放热反应,升高温度,平衡向吸热方向移动,即向逆反应方向移动,甲醇的产率降低,故A错误;
B.将CH3OH(g)从体系中分离,产物的浓度降低,平衡向正反应移动,甲醇的产率增加,故B正确;
C.充入He,使体系总压强增大,容器容积不变,反应混合物各组分浓度不变,平衡不移动,甲醇的产率不变,故C错误;
D.再充入1mol CO和3mol H2,可等效为压强增大,平衡向体积减小的方向移动,即向正反应方向移动,甲醇的产率增加,故D正确,
故答案为:BD.
点评 本题考查化学平衡计算、化学反应速率、平衡常数、化学平衡的影响因素及等,难度中等,注意控制变量法与定一议二原则应用.

| A. | 上述反应达到平衡后,其他的条件不变的情况下,只改变压强,平衡不移动 | |
| B. | 该反应的化学平衡常数为K=$\frac{c(C){c}^{3}(D){c}^{4}(E)}{c(A)c(B)}$ | |
| C. | E为气体 | |
| D. | 该反应的热化学方程式 2A(g)+B(g)?C(g)+3D(l)+4E(g)△H=-QkJ/mol |
| A. | 12C和13C为不同核素 | B. | 金刚石和C60互为同素异形体 | ||
| C. | 1H2和2H2互为同位素 | D. | 氧原子(18O)的结构示意图为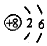 |
| A. | 醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH-=H2O | |
| B. | H2S在水溶液中的电离:H2S+H2O?H3O++HS- | |
| C. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O (g)△H=-890.3 kJ•mol-1 | |
| D. | 双氧水中加入稀硫酸和KI溶液:H2O2+2I-+H+═I2+2H2O |
| A. | 纯水中c(H+)=c(OH-) | B. | 纯水PH=7 | ||
| C. | 纯水的离子积KW=1.0×10-14 | D. | 纯水是非电解质 |
| A. | 100mL 0.5 mol/L MgCl2溶液 | B. | 200mL 0.25 mol/L KCl溶液 | ||
| C. | 100mL 0.5 mol/L HCl溶液 | D. | 100mL 0.5 mol/L NaClO溶液 |
| A. | 氢氧化钠可用于治疗胃酸过多 | |
| B. | 福尔马林可以用于是食品防腐剂 | |
| C. | 水玻璃浸泡过的木材既能防腐又能耐火 | |
| D. | Si用于制造光导纤维 |
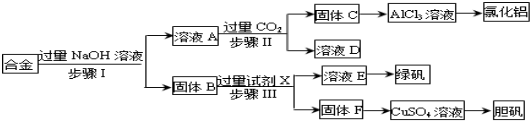

 。
。
 +6Fe2++14H
+6Fe2++14H +=2Cr3++6Fe3++7H2O。
+=2Cr3++6Fe3++7H2O。