题目内容
【题目】某化学兴趣小组试利用镁铝合金废料(不含其它杂质)制备硫酸铝晶体,其实验流程如下:
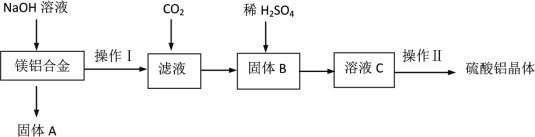
(1)在镁铝合金中加入NaOH溶液,发生反应的化学方程式为_________,固体B的化学式________。
(2)向滤液中通入足量二氧化碳的离子方程式_______________
(3)操作Ⅱ包含的实验步骤有:________、冷却结晶、过滤、洗涤、干燥。
(4)若初始时称取的镁铝合金废料的质量为7.65 g,得到固体A的质量为3.6 g,硫酸铝晶体的质量为49.95 g(假设每一步的转化率均为100%)。计算所得硫酸铝晶体的化学式为______。
【答案】2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Al(OH)3 CO2 + AlO2-+H2O=HCO3-+Al(OH)3↓ 蒸发浓缩 Al2(SO4)3·18H2O
【解析】
镁铝合金中加入NaOH溶液,金属铝完全溶解为NaAlO2溶液,金属镁不溶解,因此固体A为金属镁,过滤后得到NaAlO2溶液,向NaAlO2溶液中通入CO2,发生反应生成了Al(OH)3沉淀,即固体B为Al(OH)3,向Al(OH)3中加入稀硫酸,发生中和反应后生成了Al2(SO4)3,蒸发浓缩、冷却结晶后得到;硫酸铝晶体,据此分析作答。
(1)向镁铝合金中加入NaOH溶液,金属铝完全溶解为NaAlO2溶液,金属镁不溶解,发生的反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,固体B为Al(OH)3;
(2)过滤后得到的滤液为NaAlO2溶液,向滤液中通入过量的CO2,反应生成了Al(OH)3沉淀和碳酸氢钠,离子方程式为:CO2 + AlO2-+2H2O=HCO3-+Al(OH)3↓;
(3)操作Ⅱ的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(4)镁铝合金废料的质量为7.65 g,得到固体A(即镁)的质量为3.6 g,那么金属铝的质量为7.65-3.6=4.05g,其物质的量为0.15mol,根据铝原子守恒可得Al2(SO4)3的物质的量为0.075mol,硫酸铝晶体的的摩尔质量为![]() =666g/mol,设硫酸铝晶体的分子式为Al2(SO4)3·nH2O,那么27×2+96×3+18n=666,解得n=18,因此硫酸铝晶体的化学式为Al2(SO4)3·18H2O。
=666g/mol,设硫酸铝晶体的分子式为Al2(SO4)3·nH2O,那么27×2+96×3+18n=666,解得n=18,因此硫酸铝晶体的化学式为Al2(SO4)3·18H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
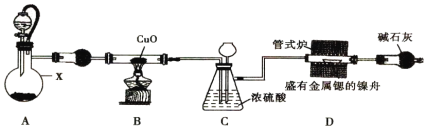
小学生10分钟应用题系列答案【题目】利用![]() 和
和![]() 为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
已知![]() 和三氯氧磷的性质如下表:
和三氯氧磷的性质如下表:
熔点 | 沸点 | 其他物理或化学性质 | |
|
|
|
|
|
|
|
(1)仪器乙的名称是__________。
(2)实验过程中仪器丁的进水口为__________(选填“![]() ”或“
”或“![]() ”)口。
”)口。
(3)装置B的作用是__________(填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压
(4)整个装置必须干燥,若未干燥,写出所有副反应的化学方程式______________________________。
(5)制备三氯氧磷所用PCl3测定纯度的方法如下:迅速称取![]() 产品,水解完全后配成
产品,水解完全后配成![]() 溶液,取出
溶液,取出![]() 入过量的
入过量的![]() 碘溶液,充分反应后再用
碘溶液,充分反应后再用![]() 溶液滴定过量的碘,终点时消耗
溶液滴定过量的碘,终点时消耗![]() 溶液。
溶液。
已知:![]() ;
;![]() ;假设测定过程中没有其他反应。根据上述数据,该产品中
;假设测定过程中没有其他反应。根据上述数据,该产品中![]() (相对分子质量为137.5)的质量分数的计算式为__________%。(用含
(相对分子质量为137.5)的质量分数的计算式为__________%。(用含![]() 的代数式表示)
的代数式表示)
【题目】为应对石油短缺,一碳化学研究备受关注。一碳化学是指以分子中只含一个碳原子的化合物如甲醇、一氧化碳等为原料,制造产品的化学体系的总称。
(1)CH3OH(g)和NH3(g)在一定条件下反应可制得甲胺CH3NH2(g)。
![]()
![]()
①已知该反应中相关的化学键键能数据如下:
共价键 | C—O | N—H | C—N | C—H |
E/(kJ/mol) | a | b | c | d |
则H—O键的键能为_________________kJ/mol(用含有字母的代数式表示)
②在某恒容密闭容器中进行该反应,其他条件不变的情况下,分别测得起始时CH3OH(g)的物质的量和温度对平衡时CH3NH2(g)的体积分数的影响,如图所示:(图中T1、T2表示温度)

则T1_________T2(填“>”、“<”或“=”);____________(填“a”、“b”或“c”)点对应的平衡状态中反应物NH3(g)的转化率最大。b、d两点的平衡常数大小关系为Kb________Kd(填“>”、“<”或“=”)。
(2)甲醇在工业上可利用水煤气来合成:![]() 。将1mol CO和2mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数
。将1mol CO和2mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数![]() (CH3OH)变化趋势如图所示:
(CH3OH)变化趋势如图所示:

图中Y轴表示的外界条件为________________,判断的理由是______________________。
已知v(正)=k(正)·p(CO)·p(H2)2,v(逆)=k(逆)·p(CH3OH),其中k(正)、k(逆)分别为正、逆反应速率常数,p为各组分的分压。在M点所处的温度(T3℃)和压强(p0kPa)下,反应在20分钟达到平衡时![]() (CH3OH)=10%,该温度下反应的平常数KP=____________kPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若在15分钟时
(CH3OH)=10%,该温度下反应的平常数KP=____________kPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若在15分钟时![]() ,此时
,此时![]() ______________(计算结果保留两位小数)
______________(计算结果保留两位小数)
【题目】下列实验现象描述正确的是( )
选项 | 实 验 | 现 象 |
A | 向氢氧化钠溶液中滴加FeCl3饱和溶液 | 有氢氧化铁胶体产生 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
C | 向滴有酚酞的溶液中加入足量Na2O2粉末 | 溶液变红 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮 |
A.AB.BC.CD.D
【题目】随着新能源汽车产业的快速发展,带来大量的废旧电池,一种以废旧磷酸铁锂电池正极为原料回收铝、铁和锂元素的工艺流程如下:

已知:①![]() 易溶于硫酸中。
易溶于硫酸中。
②磷酸铁锂电池正极材料:磷酸铁锂![]() ,乙炔黑(主要成分碳单质,着火点大于750℃)导电剂和有机粘结剂PVDF(一种高分子有机物),均匀混合后涂覆于铝箔上。
,乙炔黑(主要成分碳单质,着火点大于750℃)导电剂和有机粘结剂PVDF(一种高分子有机物),均匀混合后涂覆于铝箔上。
回答下列问题:
(1)破碎的作用是________,烧结的主要目的是________。
(2)碱溶发生的非氧化还原反应的离子方程式是________________。
(3)若在实验室中进行操作1、2、3,需要用到的玻璃仪器有________。
(4)滤渣1酸浸的目的是________。
(5)滤渣2主要成分是________。
(6)pH与Fe、Li沉淀率关系如下表,为使滤液2中Fe、Li分离,溶液的pH应调节为________。
溶液pH与Fe、Li沉淀率关系
pH | 3.5 | 5 | 6.5 | 8 | 10 | 12 |
Fe沉淀率 | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
Li沉淀率 | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
(7)碳酸锂的溶解度随温度变化如下图所示。向滤液3中加入![]() ,将温度升至90℃是为了提高沉淀反应速率和________。
,将温度升至90℃是为了提高沉淀反应速率和________。