题目内容
2.草酸作为一种很重要的化工原料,某一个学习小组的同学拟用甘蔗渣为原料用水解一氧化一水解的技术来制取草酸如图1
Ⅰ、步骤④是减压抽滤(如图2),其优点是:加快过滤速度、得到较干燥的沉淀,当抽滤完毕或中途停止抽滤时,为了防止自来水倒吸入B装置,最佳的操作是慢慢打开活塞d,然后关闭水龙头.
Ⅱ、该小组同学为了确定产品H2C2O4•xH2O中的x值,进行下列实验:
①取w g产品配成100mL水溶液;
②量取25.00mL草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol•L-1KMnO4溶液滴定. 请回答下列问题:
(1)实验①中,需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和100mL容量瓶.
(2)写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.
(3)若滴定时,前后两次读数分别为a mL和b mL,由此计算出该草酸晶体的x值是$\frac{50W}{9c(b-a)}$-5
Ⅲ、该小组同学在做实验Ⅱ②时发现向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色总是先慢后快,即反应速率由小变大.为此,他们设计了实验进行探究:
【实验用品】:仪器:试管(若干个并编号①,②,③…)、胶头滴管(若干支)、秒表
试剂:0.1mol/L H2C2O4溶液、0.1mol/L KMnO4溶液、稀硫酸、MnSO4固体
【实验内容】:实验(1):在①号和②号试管中分别先加入5m1 0.1mol/L H2C2O4溶液,然后各加10滴稀硫酸,且在②号试管中加入少量硫酸锰固体.再在两支试管中各加入5滴0.1mol/LKMnO4溶液.现象如下(表1)
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 90s | 5s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | |
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 100s | 90s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | |
| 编号 | ①号试管 | ②号试管 | ③号试管 |
| 褪色时间 | 88s | 100s | 120s |
| 实验现象 | 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | ||
实验(1)得出的结论是Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率[或需要Mn2+(硫酸锰)作催化剂],假设1成立.
(2)由实验(2)和实验(3)得出的结论是由表2和表3的实验结果可知:硫酸对草酸和高锰酸钾溶液的反应有影响,加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,草酸和高锰酸钾溶液的反应速率开始比较慢,随着反应的进行,褪色速率加快,温度对该反应速率影响不大.
分析 Ⅰ、(1)减压的操作优点是:可加快过滤速度,并能得到较干燥的沉淀;抽滤完毕或中途停止抽滤时,为保持内外压强的平衡,应先断开连接安全瓶与抽气装置间的橡皮管,该装置只需慢慢打开活塞d,然后关闭抽气装置中的水龙头;
Ⅱ、(1)配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、量筒、100mL容量瓶、胶头滴管、玻璃棒等;
(2)酸性条件下,高锰酸钾具有强氧化性,能氧化还原性物质,草酸和酸性高锰酸钾溶液发生氧化还原反应生成二氧化碳、锰离子和水;
(3)滴定管的刻度由上而下刻度增大,滴定前后两次读数分别为amL和bmL,故消耗KMnO4溶液体积(b-a)mL,根据关系式2KMnO4~5H2C2O4计算25.0mL草酸溶液中n(H2C2O4),进而计算100mL草酸溶液中n′(H2C2O4),计算草酸的质量,根据化学式质量分数计算求X的值;
【实验内容】:(1)根据表中数据知,有硫酸锰的溶液褪色时间短,反应速率快,没有硫酸锰的溶液褪色时间长、反应速率慢;
(2)根据对比实验中不同物理量确定褪色时间长短,从而确定反应速率的影响因素;
解答 解:Ⅰ、(1)减压的操作优点是:可加快过滤速度,并能得到较干燥的沉淀;抽滤完毕停止抽滤时,为防止倒吸,为保持内外压强的平衡,先慢慢打开活塞d,然后关闭水龙头,
故答案为:加快过滤速度、得到较干燥的沉淀;慢慢打开活塞d,然后关闭水龙头;
Ⅱ、(1)配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)称固体、烧杯溶解固体、100mL容量瓶配制溶液、胶头滴管定容、玻璃棒搅拌引流等,所以缺少玻璃仪器为100mL容量瓶,
故答案为:100mL容量瓶;
(2)草酸溶液与酸性高锰酸钾溶液发生氧化还原反应,生成锰离子、二氧化碳、水,该离子反应为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(3)滴定管的刻度由上而下刻度增大,滴定前后两次读数分别为amL和bmL,故消耗KMnO4溶液体积(b-a)mL,
n(KMnO4)=c mol•L-1×(b-a)×10-3L=c×(b-a)×10-3mol,
根据关系式2KMnO4~5H2C2O4可知25.0mL草酸溶液中n(H2C2O4)=2.5×c×(b-a)×10-3mol,
则100mL草酸溶液中n′(H2C2O4)=2.5×c×(b-a)×10-3mol×$\frac{100mL}{25mL}$=c×(b-a)×10-2mol,
草酸晶体中草酸的质量为c×(b-a)×10-2mol×90g/mol=0.9c(b-a)g,
由化学式可知:$\frac{90}{90+18x}$=$\frac{c×(b-a)×1{0}^{-2}mol×90g/mol}{Wg}$,解得x=$\frac{50W}{9c(b-a)}$-5,
故答案为:$\frac{50W}{9c(b-a)}$-5;
【实验内容】:(1)根据表中数据知,有硫酸锰的溶液褪色时间短,反应速率快,没有硫酸锰的溶液褪色时间长、反应速率慢,说明硫酸锰作催化剂而加快反应速率,所以可假设:反应产物中的Mn2+可能是反应的催化剂,
故答案为:反应产物中的Mn2+可能是反应的催化剂;Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率[或需要Mn2+(硫酸锰)作催化剂],假设1成立;
(2)根据实验(2)、(3)表2和表3的实验结果可知:温度不同其褪色时间不同,说明温度对该反应速率有影响,根据实验(3)知,混合溶液中硫酸浓度不同其褪色时间不同,说明硫酸对草酸和KMnO4溶液的反应有影响,加入少量硫酸,可促进草酸和KMnO4溶液反应,褪色时间变短,而加入大量硫酸,反应速率比较小,褪色时间加长,说明温度对该反应速率影响不大,
故答案为:由表2和表3的实验结果可知:硫酸对草酸和高锰酸钾溶液的反应有影响,加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,草酸和高锰酸钾溶液的反应速率开始比较慢,随着反应的进行,褪色速率加快,温度对该反应速率影响不大.
点评 本题考查了物质的分离和提纯、化学平衡移动等知识点,为高频考点,侧重于学生的分析、实验计算能量的考查,题目综合性较强,掌握减压过滤操作、有关滴定的计算是解答本题的关键,本题难度较大.

 所示转化的是( )
所示转化的是( )| 选项 | X | Y | Z | M |
| A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
| B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
| C | NH3(g) | NO | NO2 | O2 |
| D | S(s) | SO2 | SO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 甲烷与氯气光照下反应的生成的氯代物都是气体 | |
| B. | 正丁烷的四个碳原子在同一条直线上 | |
| C. | 正丁烷的熔点、沸点都比异丁烷小 | |
| D. | 分子式为CnH2n+2分子中共用电子对数为3n+1 |
 某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“酸浸”时所加入的酸是H2SO4 (填化学式).
(3)加入H2O2时发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1
(5)产品晶体中有时会混有少量绿矾(FeS04•7H20),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
(6)NiS04•7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
| A. | 用蒸馏水洗净滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液 | |
| C. | 滴定前平视滴定管刻度线,滴定终了俯视刻度线 | |
| D. | 滴定前酸式滴定管尖嘴部分有气泡,滴定终了无气泡 |


 .
. )不能与强碱性物质混合使用,其原因是
)不能与强碱性物质混合使用,其原因是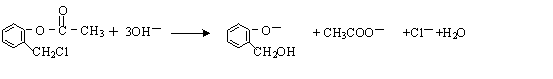 (写离子方程式).
(写离子方程式). )通过加成、取代等一系列转化合成某高分子化合物
)通过加成、取代等一系列转化合成某高分子化合物
 、
、 、
、 、
、 .
.