题目内容
甲和乙两烧杯中各装有100mL 0.2mol/LAlCl3溶液,向两烧杯中分别加入相同体积、相同浓度的NaOH溶液和氨水,两烧杯中都有沉淀生成。下列判断正确的是
A.实验过程中甲中和乙中的现象始终保持一致
B.甲中沉淀一定比乙中的少
C.甲中沉淀可能比乙中的多
D.乙中沉淀可能比甲中的多
D
【解析】
试题分析:向AlCl3溶液中加入NaOH溶液,首先发生反应:Al3++3OH-=Al(OH)3↓,产生白色沉淀;当NaOH过量时,会发生反应:Al(OH)3+ OH-= AlO2-+ 2H2O,沉淀逐渐溶解,最后完全消失;而向其中加入氨水时,发生反应:Al3++3NH3·H2O== Al(OH)3↓+3NH4+。当氨水过量时,由于NH3·H2O是弱碱,不能溶解Al(OH)3,所以沉淀不会消失。由于两烧杯中都有沉淀生成,可能NaOH稍微过量,Al(OH)3↓部分被溶解,此时乙中沉淀比甲中的多,若是二者都恰好与AlCl3溶液完全反应,此时二者产生的沉淀相同,故乙中沉淀可能比甲中的多,选项是D。
考点:考查铝盐与强碱、弱碱发生反应产生的沉淀的多少及反应现象的判断的知识。

今有甲、乙、丙、丁、戊5种物质,在一定条件下,它们能按下图方式进行转化:

其推断正确的是
选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
A | NH3 | O2 | NO | H2O | NO2 |
B | Mg | CO2 | C | MgO | CO |
C | C | H2O | CO | H2 | CO2 |
D | FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |
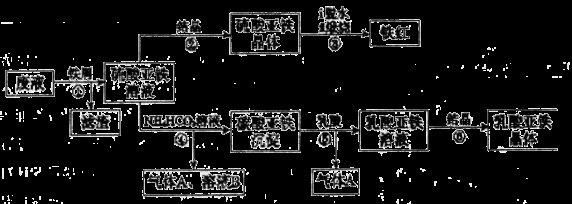
(12分)硅孔雀石是一种含铜矿石,含铜形态为CuCO3、Cu(OH)2和CuSiO3?2H2O,同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质。以其为原料制取硫酸铜的工艺流程如下图所示:
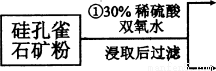
(1)步骤1中先加入足量稀硫酸,再加人双氧水。则双氧水参与该反应的离子方程式是_________________。
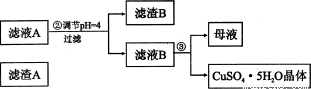
(2)步骤②调节溶液pH,可以选用的试剂是________。(填字母编号)
A.A12O3 B.CuO C.CuCO3·Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
则滤液B中含有的阳离子是__________________________。
(4)将滤液B通过_______、________、过滤等操作可得到硫酸铜晶体。
(5)硫酸铜也可用硫化铜和氧气在高温、催化剂条件下化合制得,该反应的化学方程式是______________。取384g CuS在一定条件下和氧气完全反应,若发生2CuS+3O2=2CuO+2SO2和4CuS+5O2=2Cu2O+4SO2两个反应,在所得固体中Cu和O的物质的量之比n(Cu):n(O)=4:a,此时消耗空气的物质的量为bmol。则a=__________。(氧气占空气体积的五分之一)
下列根据实验操作和现象所得出的结论,正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某钠盐溶液中滴加稀硫酸 | 产生能够使石灰水变浑浊的气体 | 该溶液中一定含有CO32-或HCO3- |
B | KIO3溶液中加入HI溶液,并加入淀粉 | 溶液变蓝色 | KIO3的氧化性比I2强 |
C | 向Na2S溶液中滴加盐酸 | 产生臭鸡蛋气味的气体 | 氯的非金属性比硫强 |
D | CO还原Fe2O3得到的黑色固体加入盐酸溶解后,再加入KSCN溶液 | 溶液不显红色 | 黑色固体中无Fe3O4 |
 Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。