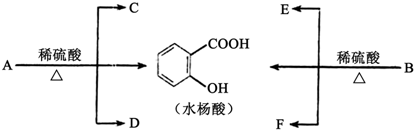
题目内容
 如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答:
如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答:(1)B、C两种原子的电子排布式
(2)短周期元素D与A同主族,则A、B、D三种元素形成的氢化物的分子构型分别是
(3)短周期元素E原子核外也有两个未成对电子,且E是形成化合物最多的元素,其常见的同素异形体的名称是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知,A处于第二周期,B、C处于第三周期,A、C两元素原子核外分别有两个、一个未成对电子,且为相邻的族,最外层电子数相差1,故A、C原子的p能级各轨道都应填充电子,则A核外电子排布为1s22s22p4,C的核外电子排布为1s22s22p63s23p5,故A为氧元素,C为Cl元素,B为P元素,据此解答.
解答:
解:由元素在周期表中的位置可知,A处于第二周期,B、C处于第三周期,A、C两元素原子核外分别有两个、一个未成对电子,且为相邻的族,最外层电子数相差1,故A、C原子的p能级各轨道都应填充电子,则A核外电子排布为1s22s22p4,C的核外电子排布为1s22s22p63s23p5,故A为氧元素,C为Cl元素,B为P元素,
(1)B为P元素,电子排布式为1s22s22p63s23p3,C为Cl元素,电子排布式为1s22s22p63s23p5,
故答案为:1s22s22p63s23p3;1s22s22p63s23p5;
(2)短周期元素D与A同主族,则D为硫元素,O、S形成的氢化物的分子构型相似,由于中心原子的价层电子对数为
=4,中心原子杂化类型为sp3杂化,中心都有两对孤电子对,所以它们的分子构型都是 V形,PH3中,P原子的价层电子对数为
=4,中心原子杂化类型为sp3杂化,有一对孤电子对,所以PH3的分子构型三角锥形,根据元素周期律,同主族元素从上向下,氢化物稳定性减弱,同周期元素从左向右,氢化物的稳定性增强,所以A、B、C、D四种元素氢化物的稳定性由强到弱的顺序为H2O>HCl>H2S>PH3,
故答案为:V形;三角锥形;V形;sp3;sp3;sp3;H2O>HCl>H2S>PH3;
(3)短周期元素E原子核外也有两个未成对电子,且E是形成化合物最多的元素,则E为碳元素,其常见的同素异形体有金刚石、石墨,
故答案为:金刚石、石墨.
(1)B为P元素,电子排布式为1s22s22p63s23p3,C为Cl元素,电子排布式为1s22s22p63s23p5,
故答案为:1s22s22p63s23p3;1s22s22p63s23p5;
(2)短周期元素D与A同主族,则D为硫元素,O、S形成的氢化物的分子构型相似,由于中心原子的价层电子对数为
| 6+2 |
| 2 |
| 5+3 |
| 2 |
故答案为:V形;三角锥形;V形;sp3;sp3;sp3;H2O>HCl>H2S>PH3;
(3)短周期元素E原子核外也有两个未成对电子,且E是形成化合物最多的元素,则E为碳元素,其常见的同素异形体有金刚石、石墨,
故答案为:金刚石、石墨.
点评:本题主要考查了电子排布式、原子杂化轨道、分子空间构型、元素周期律等知识,中等难度,元素推断是解题的关键.

练习册系列答案
相关题目
下列溶液中Cl-的物质的量浓度与50mL 1mol/L的AlCl3溶液中Cl-的物质的量浓度相等的是( )
| A、150mL 1mol/L的NaCl溶液 |
| B、75mL2mol/L的HCl溶液 |
| C、150mL 3mol/L的KCl溶液 |
| D、75mL 1mol/L的MgCl2溶液 |
下列离子方程式书写正确的是( )
| A、二氧化碳通入过量的氢氧化钠溶液:CO2+2 OH-=CO32-+H2O |
| B、碳酸钙与硝酸反应:CO32-+2H+=H2O+CO2↑ |
| C、少量金属钠放入冷水中:2Na+2H2O=2Na++2OH-+H2↑ |
| D、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
对下列有机反应类型的认识中,错误的是( )
A、 ;取代反应 ;取代反应 | ||
| B、CH2=CH2+Br2→CH2Br-CH2Br;加成反应 | ||
C、 ;酯化反应 ;酯化反应 | ||
D、CH4+Cl2
|
下列说法不正确的是( )
| A、从HCl、HBr到HI的熔点沸点升高与范德华力大小有关 |
B、CO的一种等电子体为NO+,它的电子式为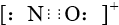 |
| C、H2O的熔点沸点大于H2S,是由于H2O分子之间存在氢键这种化学键 |
| D、电子层序数越大,s原子轨道的形状相同、半径越大 |

 科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2、压强1.0×105 Pa、反应时间3h):
科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2、压强1.0×105 Pa、反应时间3h):