题目内容
 Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(1)亚铁离子价电子层的电子排布式为
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是
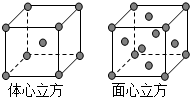
(3)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为
考点:原子核外电子排布,判断简单分子或离子的构型,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)根据铁原子构造书写Fe元素价电子层的电子排布式;
(2)①形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对;
②根据价层电子对互斥理论确定杂化方式;原子个数相等价电子数相等的微粒为等电子体;
(3)利用均摊法计算晶胞的结构;
(2)①形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对;
②根据价层电子对互斥理论确定杂化方式;原子个数相等价电子数相等的微粒为等电子体;
(3)利用均摊法计算晶胞的结构;
解答:
解:(1)亚铁离子的价电子排布式为3d6,
故答案为:3d6;
(2)①形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对,
故答案为:具有孤对电子;
②CN-中C原子与N原子键以三键连接,三键中有1个δ键、2个π键,C原子还有一对孤对电子,杂化轨道数2,C原子采取sp杂化.CN-含有2个原子,价电子总数为4+5+1=10,故其等电子体为氮气分子等,氮气分子中两个氮原子通过共用三对电子结合在一起,其电子式为 ,
,
故答案为:sp; ;
;
(3)体心立方晶胞中含有Fe原子的个数为8×
+1=2,面心立方晶胞中实际含有的Fe原子个数为8×
+6×
=4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2,
故答案为:1:2.
故答案为:3d6;
(2)①形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对,
故答案为:具有孤对电子;
②CN-中C原子与N原子键以三键连接,三键中有1个δ键、2个π键,C原子还有一对孤对电子,杂化轨道数2,C原子采取sp杂化.CN-含有2个原子,价电子总数为4+5+1=10,故其等电子体为氮气分子等,氮气分子中两个氮原子通过共用三对电子结合在一起,其电子式为
 ,
,故答案为:sp;
 ;
;(3)体心立方晶胞中含有Fe原子的个数为8×
| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:1:2.
点评:本题考查了物质结构与性质的有关知识,涉及核外电子排布式的书写、电子式的书写、杂化轨道类型的判断、等电子体、晶胞计算等,题目难度中等,注意对相关知识的积累.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
下列化学方程式或离子方程式中,书写正确的是( )
| A、乙酸钠溶液中加入少量盐酸:CH3COONa+H+-→CH3COOH+Na+ | |||
B、乙醛的银镜反应:CH3CHO+2Ag(NH3)2OH
| |||
| C、苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→C6H5OH+2CO32- | |||
D、丙烯聚合:nCH2=CHCH3
 |
常温下,下列溶液中的微粒浓度关系正确的是( )
| A、氯气与氢氧化钠溶液反应,若所得溶液恰好为中性,则c(Na+)=2c(ClO-)+c(HClO) |
| B、用NaOH 溶液吸收SO2 的过程中,当n(Na2SO3):n(NaHSO3)=1:1时(溶液pH=7.2),c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) |
| C、0.2mol?L-1CH3COOH溶液与0.1mol?L-1NaOH溶液等体积混合:2c(CH3COO-)-2c(CH3COOH)=c(H+)-c(OH-) |
| D、用0.1000 mol/L NaOH 滴定 25.00 mL 0.1000 mol/L某一元酸HX,恰好完全反应时c(X-)+c(HX)=0.1 mol/L |
 已知:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上的电子数相等;B是短周期中原子半径最大的元素;C元素的原子3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素.试回答下列有关的问题:
已知:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上的电子数相等;B是短周期中原子半径最大的元素;C元素的原子3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素.试回答下列有关的问题:
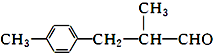
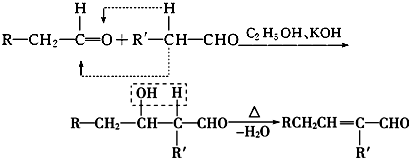 (R-代表烃基)
(R-代表烃基)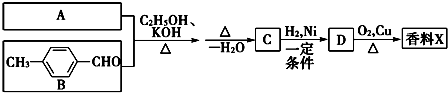
 如图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制取X的主要反应之一.
如图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制取X的主要反应之一.