题目内容
12.配制一定物质的量浓度的KOH溶液时,造成实验结果偏低的原因是( )| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 洗涤烧杯和玻璃棒的溶液未转入容量瓶中 | |
| C. | 定容时观察液面俯视 | |
| D. | 称量用的砝码已生锈 |
分析 分析操作对溶质的物质的量n和溶液体积V的影响,依据c=$\frac{n}{V}$分析,凡是使n偏小或者使V偏大的操作都会使溶液浓度偏低,凡是使n偏达或者使V偏小的操作都会使溶液浓度偏高,以此解答该题.
解答 解:A.容量瓶中原有少量蒸馏水,对实验结果没有影响,故A错误;
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中,导致溶质的物质的量偏下,浓度偏低,故B正确;
C.定容时观察液面俯视,导致体积偏小,则浓度偏大,故C错误;
D.称量用的砝码已生锈,导致砝码偏大,则称量的溶质的质量偏大,浓度偏大,故D错误.
故选B.
点评 本题考查了配制一定物质的量浓度的溶液方法及误差分析,为高频考点,题目难度不大,注意掌握配制一定物质的量浓度的溶液方法,明确误差分析的方法与技巧.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
18.下列物质的转化在给定条件下能实现的是( )
| A. | Na$→_{点燃}^{O_{2}}$Na2O$\stackrel{H_{2}O}{→}$NaOH | |
| B. | FeS2$→_{煅烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | SiO2$\stackrel{NaOH溶液}{→}$Na2SiO3溶液$\stackrel{盐酸}{→}$H2SiO3 | |
| D. | MgCO3$\stackrel{盐酸}{→}$MgCl2溶液$\stackrel{点解}{→}$Mg |
16.有机物的结构可用“键线式”表示,下列有关键线式为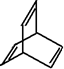 的有机物X的说法不正确的是( )
的有机物X的说法不正确的是( )
 的有机物X的说法不正确的是( )
的有机物X的说法不正确的是( )| A. | X的化学式为C8H8 | |
| B. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为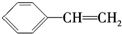 | |
| C. | X能使酸性高锰酸钾溶液褪色 | |
| D. | X与足量的H2在一定条件下反应可生成环状饱和烃Z,Z的一氯代物有4种 |
7.某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
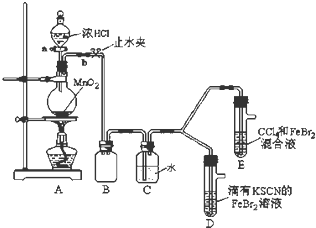
(1)①装置A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化.
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,
则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液(或FeCl3溶液)溶液,若溶液颜色变红色(或不变红),则上述解释是合理的.
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因BrCl+H2O=HBrO+H++Cl-、Ag++Cl-=AgCl↓.

(1)①装置A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,下层CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.Fe3++3SCN-?Fe(SCN)3 是一个可逆反应. ⅱ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应. ⅳ.AgClO、AgBrO均可溶于水. |
则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液(或FeCl3溶液)溶液,若溶液颜色变红色(或不变红),则上述解释是合理的.
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因BrCl+H2O=HBrO+H++Cl-、Ag++Cl-=AgCl↓.
4.下列说法中正确的是( )
| A. | 同温同压下,气体的物质的量与体积成反比 | |
| B. | 同温同体积时,气体的物质的量与压强成反比 | |
| C. | 同温同物质的量时,气体的压强与体积成正比 | |
| D. | 同压同体积时,气体的物质的量与温度成反比 |
2.下列说法正确的是( )
| A. | 20℃,1.01×105Pa下 11.2LN2含有的分子数为3.01×1023 | |
| B. | 4℃时9mL水和标准状况下11.2L氮气含有相同的分子数 | |
| C. | 同温同压下,lmol NO与lmol N2和O2的混合气体的体积不相等 | |
| D. | 0℃、1.01×10sPa时,11.2L氧气所含的原子数目为3.01×1023 |