题目内容
19.胆矾CuSO4•5H2O2可写出[Cu(H2O)4]SO4•H2O,其结构示意图如下:下列说法不正确的是( )
| A. | 该结构中所有氧原子均为sp3杂化 | |
| B. | 加热过程中胆矾中的水会分步失去 | |
| C. | 胆矾属于离子晶体,结构中存在氢键 | |
| D. | 在上述结构示意图中,存在配位键、共价键和离子键 |
分析 根据结构示意图中氧原子是否都是饱和氧原子,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,胆矾属于离子晶体以及胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子等角度分析.
解答 解:A.氧原子并不都是sp3杂化,该结构中的氧原子部分饱和,部分不饱和,杂化方式不同.从现代物质结构理论出发,硫酸根离子中S和非羟基O之间除了形成1个σ键之外,还形成了反馈π键.形成π键的电子不能处于杂化轨道上,O必须保留未经杂化的p轨道,就不可能都是sp3杂化,故A错误;
B.由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,结构上有着不同,因此加热过程中胆矾中的水会分步失去,故B正确;
C.胆矾是五水硫酸铜,胆矾是由水合铜离子及硫酸根离子构成的,属于离子晶体,结构中存在氢键,故C正确;
D.在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,故D正确;
故选:A.
点评 本题主要考查分子间作用力、杂化轨道、化学键类型等知识,注重了对物质结构中常考考点的综合,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.烯烃在一定条件下发生氧化反应时,碳碳双键发生断裂,RCH═CHR1可以氧化成RCHO和R1CHO.在该条件下,下列烯烃分别被氧化后,产物中可能有乙醛的是( )
| A. | CH3CH2CH=CHCH2CH3 | B. | CH2=CHCH2CH2CH3 | ||
| C. | CH3CH=CHCH2CH2CH3 | D. | CH3CH2CH=C(CH3)2 |
10.除第一周期外,关于同周期主族元素的下列变化规律的叙述中不正确的是( )
| A. | 从左到右,原子半径逐渐减小 | |
| B. | 从左到右,元素原子的得电子能力减弱,失电子能力增强 | |
| C. | 从左到右,气态氢化物的稳定性增强 | |
| D. | 从左到右,元素最高价氧化物对应水化物碱性减弱,酸性增强 |
7.下列说法正确的是( )
| A. | 将0.10 mol•L-1氨水加水稀释后,溶液中c(NH4+)•c(OH-)变大 | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 将CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$变大 | |
| D. | 用0.200 0 mol•L-1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合溶液中两种酸的浓度均为0.1 mol•L-1),至中性时,溶液中的酸未被完全中和 |
14.下列有关化学用语表达不正确的是( )
| A. | CO2的电子式: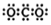 | |
| B. | CS2分子的结构式:S=C=S | |
| C. | S2-的结构示意图: | |
| D. | 8个中子的碳原子的核素符号:${\;}_6^{14}C$ |
4. 合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化.为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)?2CO(g)△H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化.为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)?2CO(g)△H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
回答下列问题:
(1)p1、p2、p3的大小关系是p1<p2<p3,欲提高C与CO2反应中CO2的平衡转化率,应采取的措施为升高温度、降低压强.图中a、b、c三点对应的平衡常数大小关系是Ka=Kb<Kc.
(2)900℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V,CO2的转化率为66.7%,该反应的平衡常数K=$\frac{16}{3V}$.
(3)将(2)中平衡体系温度降至640℃,压强降至0.1013 MPa,重新达到平衡后CO2的体积分数为50%.条件改变时,正反应和逆反应速率如何变化?正反应和逆反应速率均减小,二者之间有何关系?v(正)<v(逆).
(4)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:CO(g)+3H2(g)?CH4(g)+H2O(g)△H1=-206.2kJ/mol
CO(g)+H2O(g)?CO2(g)+H2(g)△H2=-41.2kJ/mol
①则二氧化碳与氢气反应转化为甲烷和水蒸气的热化学方程式是CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-165.0kJ/mol.
②已知298 K时相关化学键键能数据为:
则根据键能计算,△H1=-198kJ/mol,它与上述实测值差异较大的原因可能是反应温度、压强不同,键能数据不准确.
 合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化.为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)?2CO(g)△H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化.为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)?2CO(g)△H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:回答下列问题:
(1)p1、p2、p3的大小关系是p1<p2<p3,欲提高C与CO2反应中CO2的平衡转化率,应采取的措施为升高温度、降低压强.图中a、b、c三点对应的平衡常数大小关系是Ka=Kb<Kc.
(2)900℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V,CO2的转化率为66.7%,该反应的平衡常数K=$\frac{16}{3V}$.
(3)将(2)中平衡体系温度降至640℃,压强降至0.1013 MPa,重新达到平衡后CO2的体积分数为50%.条件改变时,正反应和逆反应速率如何变化?正反应和逆反应速率均减小,二者之间有何关系?v(正)<v(逆).
(4)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:CO(g)+3H2(g)?CH4(g)+H2O(g)△H1=-206.2kJ/mol
CO(g)+H2O(g)?CO2(g)+H2(g)△H2=-41.2kJ/mol
①则二氧化碳与氢气反应转化为甲烷和水蒸气的热化学方程式是CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-165.0kJ/mol.
②已知298 K时相关化学键键能数据为:
| 化学键 | H-H | O-H | C-H |  |
| E/(kJ•mol-1) | 436 | 465 | 413 | 1076 |
8.下表中对于相关物质的分类全部正确的是( )
| 选项 | 纯净物 | 混合物 | 碱性氧化物 | 非电解质 |
| A. | 液氧 | 漂白粉 | Al2O3 | CO |
| B. | 生理盐水 | 氢氧化铁胶体 | Na2O2 | 乙醇 |
| C. | 碱石灰 | 盐酸 | K2O | Cl2 |
| D. | 胆矾 | 水玻璃 | CaO | SO2 |
| A. | .A | B. | .B | C. | .C | D. | .D |
9.等量的铁分别与足量的盐酸、水蒸气在一定的条件下充分反应,则产生氢气在标准状况下的体积比是( )
| A. | 3:4 | B. | 1:2 | C. | 2:1 | D. | 1:1 |
 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.