题目内容
以下四个化学方程式(没配平),其中你认为一定不可能实现的是( )
| A、NO+HNO3=N2O3+H2O |
| B、NH3+NO=HNO2+H2O |
| C、N2O4+H2O=HNO3+HNO2 |
| D、NO+CO=N2+CO2 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:氧化还原反应中,一定存在元素的化合价升降,结合氧化还原反应中归中规律、歧化反应等来解答.
解答:
解:A.N元素的化合价可以由+2价升高为+3价,由+5价降低为+3价,能发生氧化还原反应,故A不选;
B.HNO2中N元素的化合价均比反应物中N元素的化合价高,不符合归中规律,不能发生氧化还原反应,故B选;
C.N2O4中N元素的化合价为+4价,介于生成物中N元素化合价+5、+3之间,可发生氧化还原反应,故C不选;
D.N元素的化合价降低,C元素的化合价升高,可发生氧化还原反应,故D不选;
故选B.
B.HNO2中N元素的化合价均比反应物中N元素的化合价高,不符合归中规律,不能发生氧化还原反应,故B选;
C.N2O4中N元素的化合价为+4价,介于生成物中N元素化合价+5、+3之间,可发生氧化还原反应,故C不选;
D.N元素的化合价降低,C元素的化合价升高,可发生氧化还原反应,故D不选;
故选B.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应规律的考查,注意从元素化合价角度分析,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
除去混在乙烷中的少量乙烯的最佳方法是( )
| A、将混合气体通过盛有溴水的洗气瓶 |
| B、将混合气体与HCl加成 |
| C、将混合气与H2加成 |
| D、将混合气体与氯气混合光照 |
下列文字表述与反应方程式对应不正确的是( )
A、甲烷和氯气取代:CH4+Cl2
| |||
B、乙烯和水加成:CH2=CH2+H2O
| |||
C、苯酚钠溶液中通少量CO2:CO2+H2O+ → → +HCO3- +HCO3- | |||
D、实验室用液溴和苯在催化剂作用下制溴苯: +Br2 +Br2
 +HBr +HBr |
下列转化,需要加入氧化剂才能完成的是( )
| A、H+→H2 |
| B、MnO4-→Mn2+ |
| C、CO2→CO32- |
| D、S2-→SO42- |
下列叙述正确的是( )
| A、P4和CO2分子中都只含有共价键 |
| B、CCl4和NH3的分子的立体结构都是正四面体形 |
| C、BF3分子中各原子均达到8e-稳定结构 |
D、甲烷的结构式为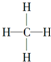 ,它是对称的平面形分子 ,它是对称的平面形分子 |
