题目内容
3.将足量SO2通入下列各溶液中,所含离子还能大量共存的是( )| A. | K+、Na+、SiO32-、Cl- | B. | H+、NH4+、Al3+、SO42- | ||
| C. | Na+、CO32-、SO32- SO42- | D. | Na+、S2-、OH-、Cl- |
分析 足量SO2通入各溶液中,根据离子之间不能结合生成沉淀、气体、水等,不能发生强酸制取弱酸的反应等,则离子大量共存,以此来解答.
解答 解:A.SO2与SiO32-反应生成硅酸沉淀,不能共存,故A不选;
B.通入二氧化硫气体,离子之间不反应,故B选;
C.SO2与CO32-反应生成气体,SO2与SO32-反应生成亚硫酸氢根离子,不能共存,故C不选;
D.SO2与OH-反应生成亚硫酸根离子,不能共存,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
9.下列有关说法错误的是( )
| A. | 明矾可用于净水 | |
| B. | 氯水保存在棕色瓶中,并置于冷暗处 | |
| C. | 氯元素在自然界主要以氯气形式存在 | |
| D. | 氯气被广泛用于医药合成、农药生产等方面 |
11.下列解释事实的化学方程式或离子方程式不正确的是( )
| A. | 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2═I2+2H2O | |
| B. | 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4 | |
| C. | 在燃煤时加入适量石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2 | |
| D. | 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3+Na2SO4 |
8.下列离子方程式书写正确的是( )
| A. | 氢氧化铁溶于氢碘酸中$Fe{(OH)_3}+3{H^+}=F{e^{3+}}+3{H_2}O$ | |
| B. | 次氯酸钙溶液中通入过量的二氧化碳Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| C. | 向100mL 0.1moL/L的溴化亚铁溶液中通入0.015 mol的氯气$2F{e^{2+}}+4B{r^-}+3C{l_2}=2F{e^{3+}}+2B{r_2}+6C{l^-}$ | |
| D. | 向明矾溶液逐滴加入氢氧化钡溶液至铝离子刚好完全沉淀$A{l^{3+}}+S{O_4}^{2-}+B{a^{2+}}+3O{H^-}=BaS{O_4}↓+Al{(OH)_3}↓$ |
15.废水中CrO42-浓度降至5.0×10-7mol•L-1以下才能排放.含CrO42-的废水可用沉淀法处理:加入可溶性钡盐生成BaCrO4沉淀,再加入可溶性硫酸盐处理多余的Ba2+.加入可溶性钡盐后的废水中Ba2+的浓度应不小于(已知:Ksp(BaCrO4)=1.2×10-10)( )
| A. | 1.2×10-5 mol•L-1 | B. | 2.4×10-4 mol•L-1 | ||
| C. | 3.6×10-4 mol•L-1 | D. | 4.8×10-4 mol•L-1 |
12.各取1mol 下列物质与溴水充分反应,消耗Br2的物质的量按①②顺序排列正确的是( )
①漆酚: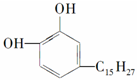 ②白藜芦醇
②白藜芦醇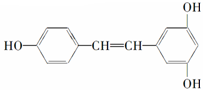
①漆酚:
 ②白藜芦醇
②白藜芦醇
| A. | 2mol、6mol | B. | 5mol、6mol | C. | 4mol、5mol | D. | 3mol、6mol |
13.2014年7月31日中国经济网:河北省开展“环保亮剑”专项整治行动,强化“三废”治理.某工厂废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等成分,回收废渣中的金属元素的工艺流程如图所示:
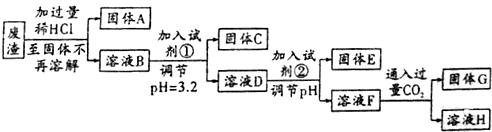
己知:常温下,饱和氨水的pH约为11,金属离子沉淀所需pH数据如表所示:
(1)试剂①为C,试剂②为B;
A.AgNO3 B.NaOH C.NH3•H2O D.H2SO4
(2)固体C的化学式是Fe(OH)3,溶液F中金属元素的存在形式为AlO2-、Na+;
(3)写出固体A与试剂②反应的化学方程式:SiO2+2NaOH=Na2SiO3+H2O;F中通入过量CO2所发生的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)加入试剂②,实现溶液D到溶液F的转化,则调节溶液的pH为D.
A.6 B.10 C.12 D.13
(5)25℃时,按(4)调节pH后测得溶液F中c(Mg2+)=5.6×10-10mol/L,则氢氧化镁的Ksp=5.6×10-12;
(6)最后一步反应中涉及到两种盐,其中酸式盐的溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).

己知:常温下,饱和氨水的pH约为11,金属离子沉淀所需pH数据如表所示:
| 离子 | 以氢氧化物形式完全沉淀时所需pH | 氢氧化物沉淀完全溶解时所需pH |
| Fe3+ | 3.2 | |
| A13+ | 5.3 | 11.9 |
| Mg2+ | 12.3 |
A.AgNO3 B.NaOH C.NH3•H2O D.H2SO4
(2)固体C的化学式是Fe(OH)3,溶液F中金属元素的存在形式为AlO2-、Na+;
(3)写出固体A与试剂②反应的化学方程式:SiO2+2NaOH=Na2SiO3+H2O;F中通入过量CO2所发生的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)加入试剂②,实现溶液D到溶液F的转化,则调节溶液的pH为D.
A.6 B.10 C.12 D.13
(5)25℃时,按(4)调节pH后测得溶液F中c(Mg2+)=5.6×10-10mol/L,则氢氧化镁的Ksp=5.6×10-12;
(6)最后一步反应中涉及到两种盐,其中酸式盐的溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
 )的二氯取代物有10种,则萘的六氯代物有10.
)的二氯取代物有10种,则萘的六氯代物有10. .
.