题目内容
1.处处留心皆知识,生活中的下列事实,不涉及到化学变化的是( )| A. | 食物腐败变质 | B. | 酒香不怕巷子深 | ||
| C. | 铝表面形成致密的薄膜 | D. | 食醋洗掉水垢 |
分析 A.食物腐败发生缓慢氧化;
B.乙醇的挥发性是分子间距离的变化;
C.Al与氧气反应生成致密的氧化铝;
D.醋酸与水垢中碳酸钙反应.
解答 解:A.食物腐败发生缓慢氧化,发生氧化还原反应,故A不选;
B.酒香不怕巷子深是指乙醇易挥发,为物理变化,故B选;
C.Al与氧气反应生成致密的氧化铝,发生氧化还原反应,故C不选;
D.醋酸与水垢中碳酸钙反应,生成醋酸钙溶于水,则食醋可洗掉水垢,发生复分解反应,故D不选;
故选B.
点评 本题考查物质的性质及反应,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
13.有两种金属组成的合金50克,与足量氯气反应,共用去氯气71克,则该合金不可能的组成是( )
| A. | 锌和铁 | B. | 钠和铝 | C. | 钙和铜 | D. | 锌和钙 |
12.钠多以资源丰富的NaCl为原料来制备,下列方法中能够制备出金属钠的是( )
| A. | 加热NaCl晶体 | B. | 用金属钾与NaCl溶液反应 | ||
| C. | 电解NaCl溶液 | D. | 电解熔融的NaCl |
9.下列解释事实的方程式不正确的是( )
| A. | 硫酸是强酸:H2SO4=2H++SO42- | |
| B. | CO2使澄清石灰水变浑浊:CO2+2OH-=CO32-+H2O | |
| C. | SO2通入水中溶液显酸性:SO2+H2O?H2SO3 | |
| D. | H2具有还原性:CuO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O |
16. 如图是汽车尾气催化转化装置工作原理示意图:
如图是汽车尾气催化转化装置工作原理示意图:
下列说法不正确的是( )
 如图是汽车尾气催化转化装置工作原理示意图:
如图是汽车尾气催化转化装置工作原理示意图:下列说法不正确的是( )
| A. | 汽车尾气是雾霾成因之一,主要有CO、NO | |
| B. | 该过程中NO2既是生成物又是反应物 | |
| C. | 该过程中氧元素被还原,氮元素被氧化 | |
| D. | 该过程中会有反应:2NO2+4CO$\frac{\underline{\;催化剂\;}}{\;}$4CO2+N2 |
6.从微观角度看,影响一定质量某气体体积大小的决定因素是( )
| A. | 气体分子数 | B. | 气体分子的体积 | ||
| C. | 气体分子间的平均距离 | D. | 气体分子的质量 |
13.分离和提纯物质的方法不仅用于实验研究而且广泛应用于工业生产和生活实际.
(1)海水晒盐过程中,采用蒸发方法可得到粗盐固体;将粗盐固体溶解后,为去除其中的泥沙应采用的方法是过滤.
粗盐中除泥沙外还含有可溶性杂质(如下表所示),可按下表所示顺序依次除去(将表格填写完整).
依次加入上述试剂后,再加入适量稀盐酸可除去上述步骤引入的杂质离子
(2)利用海水各组分沸点不同获得淡水的方法是蒸馏.
(3)从海带中可提取碘单质.用萃取的方法可将碘单质从水溶液中提取出来该方法利用了I2在不同溶剂中的溶解性不同.
(1)海水晒盐过程中,采用蒸发方法可得到粗盐固体;将粗盐固体溶解后,为去除其中的泥沙应采用的方法是过滤.
粗盐中除泥沙外还含有可溶性杂质(如下表所示),可按下表所示顺序依次除去(将表格填写完整).
| 杂质 | 加入试剂的化学式 |
| 硫酸盐 | BaCl2 |
| MgCl2 | NaOH |
| CaCl2 | Na2CO3 |
(2)利用海水各组分沸点不同获得淡水的方法是蒸馏.
(3)从海带中可提取碘单质.用萃取的方法可将碘单质从水溶液中提取出来该方法利用了I2在不同溶剂中的溶解性不同.
10.H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在,现以Al-H2O2燃料电池为电源,采用电化学法还原CO2,图是利用此法制备ZnC2O4的装置图(电解液不参与反应),下列说法正确的是( )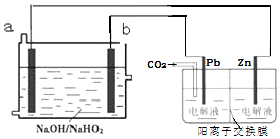

| A. | a为电源的负极 | |
| B. | 阴极的电极反应式为2CO2+2e-═C2O42- | |
| C. | 电解过程中电子的流向为b→Pb→Zn→a | |
| D. | a电极每消耗1mol HO2-,同时可制得0.5molZnC2O4 |
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 反应6NaBH4+2FeC13+18H2O=2Fe+6NaCl+6H3BO3+21H2↑可制纳米铁,该反应中每生成1 mol Fe,转移的电子数目为3NA | |
| B. | 标准状况下,22.4L甲醇完全燃烧后生成的CO2分子数为NA | |
| C. | 1mol氯气与过量铁反应,转移的电子数为3NA | |
| D. | 30g甲酸甲酯与葡萄糖的混合物中含有的原子数为4NA |