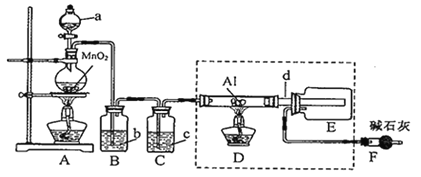
题目内容
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电脑显示屏生产过程中有大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)产生。某课题组以此粉末为原料回收铈,设计实验流程如下:
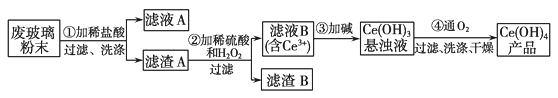
(1)滤渣A的主要成分是_____________;洗涤滤渣A除去的阳离子主要是________(填离子符号),检验该离子是否洗净的操作是________________________;
(2)步骤②中反应的离子方程式是_____________________;
(3)萃取是分离稀土元素的常用方法。已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有________、烧杯、玻璃棒、量筒等;
(4)步骤④中反应化学方程式为______________________________。
【答案】SiO2、CeO2 Fe3+ 取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净;反之,未洗净 2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O 不能 分液漏斗 4Ce(OH)3+O2+2H2O=4Ce(OH)4
【解析】
废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)中加入稀盐酸,Fe2O3转化FeCl3存在于滤液中,滤渣为CeO2和SiO2;加入稀硫酸和H2O2,CeO2转化为Ce3+,滤渣为SiO2;加入碱后Ce3+转化为沉淀,最后通入氧气将Ce从+3氧化为+4,得到产品Ce(OH)4,据此解答。
(1)根据上述分析可知,加入稀盐酸时,Fe2O3与HCl反应产生FeCl3和水,SiO2、CeO2不能溶解,进入滤渣A中,因此滤液A的主要成分是Fe2O3与HCl反应产生的Fe3+;检验Fe3+的方法是取最后一次洗涤液,加入KSCN溶液,若不出现红色,则证明沉淀已洗净;反之,沉淀未洗净;
(2)稀硫酸、H2O2,CeO2三者反应生成转化为Ce2(SO4)3、O2和H2O,反应的离子方程式为:6H++H2O2+2CeO2=2Ce3++O2↑+4H2O;
(3)化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,萃取剂与水互不相容,而且Ce3+在萃取剂中的溶解度比在水中的大,所以TBP不能与水互溶;实验室进行萃取操作时用到的主要玻璃仪器有分液漏斗、烧杯、玻璃棒、量筒等;
(4)Ce(OH)3与O2、H2O在加热时发生氧化还原反应,Ce(OH)3被氧化为Ce(OH)4,根据原子守恒、电子守恒,可得反应的化学方程式:4Ce(OH)3+O2+2H2O=4Ce(OH)4。

【题目】制备苯甲酸的反应原理及有关数据如下:

名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 溶解度 |
甲苯 | 92 | 无色液体 | -95℃ | 110℃ | 不溶于水 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122℃ | 248℃ | 微溶于水 |
高锰酸钾 | 158 | 易溶于水 |
实验过程如下: ①将高锰酸钾、水和氢氧化钠溶液混合摇匀后,加入甲苯,采用电磁搅拌,加热(但温度不要太高),冷凝回流2h。如仍有高锰酸钾的紫色存在,则加数滴乙醇。 ②将混合液过滤后冷却。③滤液用盐酸酸化,析出白色晶体过滤,洗涤,干燥,得到苯甲酸的粗产品,最后测定其熔点。回答下列问题:
(1)①中反应易暴沸,本实验中采用______方法防止此现象;乙醇的作用是____________________。
(2)②中过滤出的沉淀是____________________。
(3)③中测定熔点时,发现到130℃ 时仍有少量不熔,推测此不熔物的成分是____________________。
(4)提纯苯甲酸粗产品的方法是____________________。
【题目】(1)已知在常温常压下:
①CH3OH(l)+O2(g)===CO(g)+2H2O(g) ΔH=-354.8 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1
则表示CH3OH(l)燃烧热的热化学方程式为______________________________________。
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,充电一次可使手机连续使用一个月。
①该电池负极的电极反应式为________________________________________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl- | SO42- |
c/(mol·L-1) | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)。阳极上最先发生的反应为___________________________;从各阶段的电解总反应方程式来看,最初是电解__________(填写化学式,下同)溶液,然后是电解________溶液,最后是电解H2O。