题目内容
5.某化学研究性学习小组需配制含有NH4+、Cl-、K+、SO42-的植物培养液450mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1.实验室提供的药品有:NH4+Cl、KCl、(NH4+)2SO4、K2SO4和蒸馏水.请回答下列问题:(1)该植物培养液中,NH4+的物质的量浓度为0.8mol/L.
(2)甲同学用KCl和(NH4)2SO4两种物质进行配制,则需称取m(KCl)=14.9g,m[(NH4)2SO4]=26.4g.
(3)乙同学用(NH4)2SO4、NH4Cl和K2SO4三种物质进行配制,则(NH4)2SO4、NH4Cl、K2SO4三种物质的物质的量之比是1:2:1.
分析 配制含有NH4+、Cl-、K+、SO42-的植物培养液450mL,实验室中没有450mL的容量瓶,实际上配制的是500mL该溶液,
(1)要求该培养液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1,依据电荷守恒计算溶液中铵根离子浓度;
(2)依据m=cVM及质量守恒定律计算选用溶质的质量;
(3)已知培养液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1,根据质量守恒计算出(NH4)2SO4、NH4Cl和K2SO4的物质的量,再计算出三者的物质的量之比.
解答 解:配制含有NH4+、Cl-、K+、SO42-的植物培养液450mL,实验室中没有450mL的容量瓶,实际上配制的是500mL该溶液,
(1)且要求该培养液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1,依据溶液中电荷守恒规律可知:
c(Cl-)+2c(SO42-)=c(K+)+c(NH4+),0.4mol/L+2×0.4mol/L=0.4mol/L+c(NH4+),得c(NH4+)=0.8mol/L;
故答案为:0.8mol/L;
(2)要求该培养液中c(Cl-)=c(K+)=0.4mol•L-1,c(NH4+)=0.8mol/L,则需要氯化钾的物质的量浓度为0.4mol/L,需要氯化钾固体质量为:m=0.4mol/L×0.5L×74.5g/mol=14.9g;
要使c(SO42-)=0.4mol•L-1,c(NH4+)=0.8mol/L,则需要硫酸铵的物质的量浓度为0.4mol/L,需要硫酸铵固体质量为:m=0.4mol/L×0.5L×132g/mol=26.4g,
故答案为:14.9;26.4;
(3)配制含有NH4+、Cl-、K+、SO42-的植物培养液500mL,且溶液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1,根据(1)可知c(NH4+)=0.8mol/L,根据钾离子守恒需要K2SO4的物质的量为:n(K2SO4)=$\frac{1}{2}$×0.4mol/L×0.5L=0.1mol,根据硫酸根离子守恒可知需要(NH4)2SO4的物质的量为:n((NH4)2SO4)=0.4mol/L×0.5L-0.1mol=0.1mol,根据铵根离子守恒可知需要NH4Cl的物质的量为:n(NH4Cl)=0.8mol/L×0.5L-0.1mol×2=0.2mol,
所以则(NH4)2SO4、NH4Cl、K2SO4三种物质的物质的量之比=0.1mol:0.2mol:0.1mol=1:2:1,
故答案为:1:2:1.
点评 本题考查了物质的量浓度的计算,题目难度中等,正确判断配制溶液的体积为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析、理解能力及化学计算能力.

 阅读快车系列答案
阅读快车系列答案| A. | 常温下,1L0.1mol/L的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 1mol羟基中电子数为10NA | |
| C. | 在含4mol Si-O键的二氧化硅中,氧原子数为4NA | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
| A. | 该反应中氧化剂只有FeCl3 | |
| B. | NaBH4的电子式为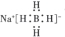 | |
| C. | NaBH4与稀硫酸不发生反应 | |
| D. | 该反应中每生成1 mol Fe,转移的电子数为3mol |
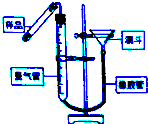
| A. |  制备氢氧化亚铁并观察其颜色 | B. |  气密性检 | ||
| C. |  制备并检验氢气的可燃性 | D. |  浓硫酸稀释 |

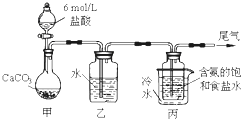
 过氧化钙(CaO2•8H2O)是一种在水产养殖中广泛使用的供氧剂.
过氧化钙(CaO2•8H2O)是一种在水产养殖中广泛使用的供氧剂.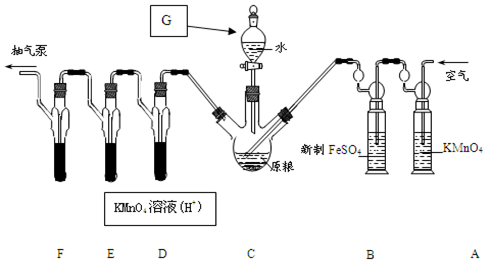
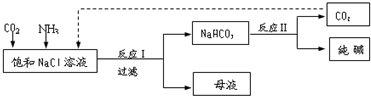
 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.