题目内容
8.金属活动顺序表对金属学习有很好的指导作用,以下应用正确的是( )| A. | 由2Al+6H+=2Al3++3H2↑可知2Fe+6H+═2Fe3++3H2↑ | |
| B. | 由Na与水反应可知2Al+6H2O═2Al(0H)3+3H2↑ | |
| C. | 由Na2O为碱性氧化物,Al2O3为两性氧化物可知,Fe2O3为酸性氧化物 | |
| D. | 由Na不能从CuSO4溶液置换出Cu可知,K也不能与FeCl3溶液反应置换出Fe |
分析 A.稀盐酸和稀硫酸具有弱氧化性,和变价金属反应时能将变价金属氧化为较低价态;
B.钠活动性大于铝,钠能和水反应,但铝和水不反应;
C.能和碱反应只生成盐和水的氧化物是酸性氧化物,能和酸反应只生成盐和水的氧化物是碱性氧化物;
D.K活动性大于Na,Na、K通入盐溶液中时先和水反应,生成的碱再和盐发生复分解反应.
解答 解:A.稀盐酸和稀硫酸具有弱氧化性,和变价金属反应时能将变价金属氧化为较低价态,所以Fe和稀盐酸或稀硫酸反应方程式为Fe+2H+═Fe2++H2↑,故A错误;
B.钠活动性大于铝,钠能和水反应,但铝和水不反应,故B错误;
C.能和碱反应只生成盐和水的氧化物是酸性氧化物,能和酸反应只生成盐和水的氧化物是碱性氧化物,氧化铁和酸反应只生成盐和水,所以氧化铁是碱性氧化物,故C错误;
D.K活动性大于Na,Na、K通入盐溶液中时先和水反应,生成的碱再和盐发生复分解反应,所以K通入氯化铁溶液时先和水反应生成KOH,生成的KOH再和氯化铁发生复分解反应生成氢氧化铁沉淀,故D正确;
故选D.
点评 本题考查金属及其化合物性质,为高频考点,明确金属活动性顺序及金属性质是解本题关键,注意稀硫酸和浓硫酸性质差异性区别,易错选项是A.

练习册系列答案
相关题目
16.已知室温下,某溶液中由水电离出的H+和OH-的物质的量浓度的乘积约为1×10-24,则在该溶液中,一定能大量存在的离子是( )
| A. | NH4+ | B. | NO3- | C. | AlO2- | D. | HCO3- |
3.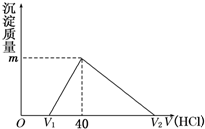 将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如下图所示,则下列选项正确的是( )
将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如下图所示,则下列选项正确的是( )
 将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如下图所示,则下列选项正确的是( )
将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如下图所示,则下列选项正确的是( )| A. | 图中m值为1.56 g | B. | 标准状况下产生氢气896 mL | ||
| C. | 图中V2为60 mL | D. | 原合金质量为0.92 g |
13.Ⅰ:工业制硫酸时,利用接触氧化反应将SO 2转化为SO3是一个关键步骤.
(1)某温度下,2SO2(g)+O 2(g)?2SO3(g)△H=-197kJ/mol.开始时在10L的密闭容器中加入8.0mol SO2(g)和20.0mol O 2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K=0.56(保留两位有效数字),若升高温度时,K将减小(填“增大、减小或不变”).
(2)若体积不变的条件下,下列措施中有利于提高SO2的转化率条件是AC(填字母).
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(3)在硫酸工业生产过程中,有反应2SO2(g)+O2(g)?2SO3(g)(正反应为放热反应),根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件(以V2O5作催化剂)温度450℃;压强1×105Pa.
(4)能判断该反应达到平衡状态的依据是ACF.
A.容器的压强不变 B.混合气体的密度不变
C.混合气体中SO 3的浓度不变 D.C(SO 2)=C(SO 3)
E.v 正(SO 2)=v 正(SO 3) F.v 正(SO 3)=2v 逆(O 2)
Ⅱ:研究化学反应原理对于生产生活是很有意义的.
(1)在0.10mol•L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=2.2×10-8mol•L-1(Ksp[Cu(OH)2]=2.2×10-20).
(2)若在0.1mol•L-1硫酸铜溶液中通入H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是0.2mol•L-1.
(1)某温度下,2SO2(g)+O 2(g)?2SO3(g)△H=-197kJ/mol.开始时在10L的密闭容器中加入8.0mol SO2(g)和20.0mol O 2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K=0.56(保留两位有效数字),若升高温度时,K将减小(填“增大、减小或不变”).
(2)若体积不变的条件下,下列措施中有利于提高SO2的转化率条件是AC(填字母).
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(3)在硫酸工业生产过程中,有反应2SO2(g)+O2(g)?2SO3(g)(正反应为放热反应),根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件(以V2O5作催化剂)温度450℃;压强1×105Pa.
| 1×105Pa | 5×105Pa | 10×105Pa | 50×105Pa | 100×105Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
A.容器的压强不变 B.混合气体的密度不变
C.混合气体中SO 3的浓度不变 D.C(SO 2)=C(SO 3)
E.v 正(SO 2)=v 正(SO 3) F.v 正(SO 3)=2v 逆(O 2)
Ⅱ:研究化学反应原理对于生产生活是很有意义的.
(1)在0.10mol•L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=2.2×10-8mol•L-1(Ksp[Cu(OH)2]=2.2×10-20).
(2)若在0.1mol•L-1硫酸铜溶液中通入H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是0.2mol•L-1.
17.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝与过量氨水:Al3++4OH-═AlO2-+H2O | |
| B. | 钠和冷水反应:Na+2H2O═Na++2OH-?+H2↑ | |
| C. | 氯气与水反应Cl2+H2O?Cl-+H++HClO | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
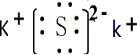 ,属于离子晶体.
,属于离子晶体.