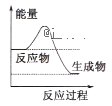
题目内容
【题目】化学环分解氯化铵的纯碱和氯乙烯集成清洁工艺如下:
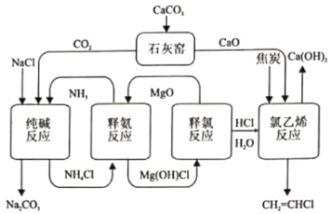
(1)“释氨反应”步骤可能发生的化学反应:
NH4Cl(s)≒ NH3(g)+HCl(g) ΔH=163.57 kJ/mol
MgO(s)+ HCl(g) ≒ MgOHCl(s) ΔH=-102.23 kJ/mol
则总反应NH4Cl(s)+MgO(s)≒NH3(g)+MgOHCl(s) ΔH=____kJ/mol
(2)“释氯反应”可能的化学反应有:
i. MgOHCl(s)≒MgO(s)+ HCl(g) ΔH=+97.50 kJ/mol
ii. MgOHCl(s)+ HCl(g)≒MgCl2(s)+H2O(g) ΔH=+2.89 kJ/mol
iii. MgCl2(s)+ H2O(g)=MgO(s)+2HCl(g) ΔH=+94.61 kJ/mol
图为“释氯反应”在不同温度下各组分的平衡组成,回答下列问题
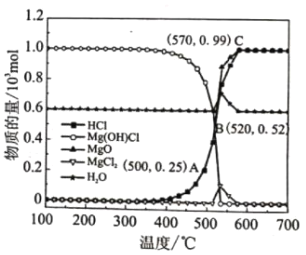
①应选择的最佳反应温度是___________
②500°C时,释氯反应器的压强为P,计算该温度下反应i的平衡常数Kp=___________ (Kp为以分压表示的平衡常数)
③结合平衡移动原理,原料气增加水蒸气的目的是___________
(3)“氯乙烯反应”中,![]() (g)+HCl(g)
(g)+HCl(g)![]() CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
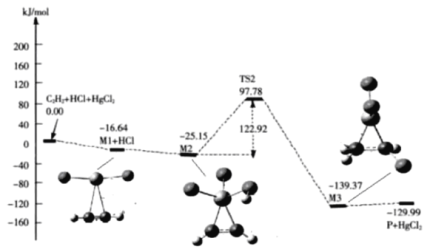
①碳碳叁键的键能:M1_____ ![]() (填“>”或“<”)
(填“>”或“<”)
②“M2→M3”的化学方程式为__________
③该反应的决速步骤为__________
(4)下列有关该工艺的说法不正确的是______(填标号)
A.可循环利用的物质有NH3、MgO、HCl
B.“石灰窑”和“纯碱反应”的副产物可实现资源化利用
C.利用MgO作为吸附剂可有效实现NH3与HCl分离
D.减少了从氯碱工业的产品获取HCl的电能消耗
【答案】61.34 570℃ ![]() 水蒸气的加入,可促进平衡ii逆向移动,平衡iii正向移动,提高HCl的产量 <
水蒸气的加入,可促进平衡ii逆向移动,平衡iii正向移动,提高HCl的产量 < ![]() M2→M3 A
M2→M3 A
【解析】
(1)反应①:NH4Cl(s)≒ NH3(g)+HCl(g) ΔH=163.57 kJ/mol
反应②:MgO(s)+ HCl(g) ≒ MgOHCl(s) ΔH=-102.23 kJ/mol
由反应①+反应②可得:NH4Cl(s)+MgO(s)≒NH3(g)+MgOHCl(s) ΔH=61.34kJ/mol,
故答案为:61.34;
(2)①“释氯反应”过程中,HCl的含量在570℃之前逐渐增加,在570℃后几乎不变,因此应选择的最佳反应温度为570℃,
故答案为:570℃;
②由图像可知,500℃下,n(HCl)=0.25mol,n(H2O)=0.6mol,体系中HCl的分压p(HCl)= ![]() =
=![]() ,故反应i的平衡常数Kp= p(HCl)=
,故反应i的平衡常数Kp= p(HCl)=![]() ,
,
故答案为:![]() ;
;
③原料气中增加水蒸气可促进平衡ii逆向移动,平衡iii正向移动,提高HCl的产量,
故答案为:可促进平衡ii逆向移动,平衡iii正向移动,提高HCl的产量;
(3)①.由流程图可知,![]() +HgCl2+HCl能量高于M1+HCl,故M1键能小于碳碳三键键能,
+HgCl2+HCl能量高于M1+HCl,故M1键能小于碳碳三键键能,
故答案为:<;
②.M2→M3反应过程是在催化剂表面完成的,根据结构式可知其化学方程式为:![]() ,
,
故答案为:![]() ;
;
③.整个反应机理过程中,M2→M3反应过程中能垒较高,因此决速步骤为M2→M3,
故答案为:M2→M3;
(4)A、整个过程中,HCl不属于循环利用的物质,故A符合题意;
B、“石灰窑”中产物均完全利用,“纯碱反应”的副产物Na2CO3具有较为广泛的应用,实现了资源化利用,故B不符合题意;
C、MgO属于碱性氧化物,能与HCl反应生成固体MgCl2,而NH3不反应,可实现NH3与HCl分离,故C不符合题意;
D、此工艺中HCl实现了“自产自销”,不需要利用从氯碱工业制备获取HCl,节约了电能消耗,故D不符合题意;
故答案为A。

【题目】工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g)+Q
CH3OH(g)+Q
32、能判断反应达到平衡状态的依据是(填字母序号,下同)________。
A.生成CH3OH的速率与消耗CO的速率相等 | B.混合气体的密度不变 |
C.混合气体的平均相对分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
33、下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应Q________(填“>”、“=”或“<”)0;
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2 mol/L,则CO的转化率为________,此时的温度为________。
34、要提高CO的转化率,可以采取的措施是________。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
35.寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由:___________________________________________________。