题目内容
【题目】(化学——选修3:物质结构与性质)
磷元素在生产和生活中有广泛的应用。
(1)P原子价电子排布图为__________________________。
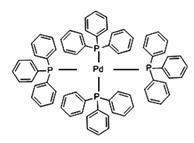
(2)四(三苯基膦)钯分子结构如下图:
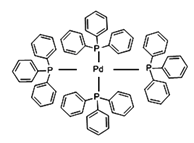
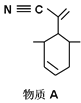
P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为___________;判断该物质在水中溶解度并加以解释_______________________。该物质可用于右上图所示物质A的合成:物质A中碳原子杂化轨道类型为__________________;一个A分子中手性碳原子数目为__________________。
(3)在图示中表示出四(三苯基膦)钯分子中配位键:_____________
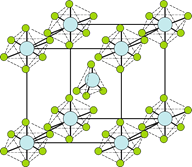
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为_____________________;正四面体形阳离子中键角小于PCl3的键角原因为__________________;该晶体的晶胞如右图所示,立方体的晶胞边长为a pm,NA为阿伏伽德罗常数的值,则该晶体的密度为_______g/cm3。
(5)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因___________________。
【答案】![]() )sp3 不易溶于水,水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶 sp、sp2、sp3 3
)sp3 不易溶于水,水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶 sp、sp2、sp3 3  PCl4+和PCl6- 两分子中P原子杂化方式均为sp3杂化,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对。孤电子对对成键电子的排斥力大于成键电子对间的排斥力
PCl4+和PCl6- 两分子中P原子杂化方式均为sp3杂化,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对。孤电子对对成键电子的排斥力大于成键电子对间的排斥力 ![]() 或
或![]() PBr5=PBr4++Br-
PBr5=PBr4++Br-
【解析】
(1)P原子价电子排布式为3s22p3,结合泡利原理、洪特规则画出价电子排布图;
(2)P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为sp3;四(三苯基膦)钯分子为非极性分子,而水是极性分子,结合相似相溶原理判断;A分子中C原子均没有孤对电子,三键中C原子杂化轨道数目为2,双键中碳原子杂化轨道数目为3,其它碳原子杂化轨道数目为4;连接4个不同的原子或原子团的碳原子为手性碳原子;
(3)Pd含有空轨道,P原子有1对孤对电子,提供孤对电子与Pd形成配位键;
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,形成的正四面体形阳离子为PCl4+,正六面体形阴离子为PCl6-;PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,孤电子对对成键电子的排斥力大于成键电子对间的排斥力;由晶胞结构可知,PCl4+位于体心,PCl6-位于顶点,由均摊法可知晶胞中含有1个PCl6-,计算晶胞质量,再根据ρ=![]() 计算晶胞密度;
计算晶胞密度;
(5)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,则电离生成PBr4+与Br-。
(1)磷是15号元素,其原子核外有15个电子,P元素基态原子电子排布为1s22s22p63s23P3,P的最外层3p电子3个电子自旋方向相同,为![]() ,故答案为
,故答案为![]() ;
;
(2)P原子以正四面体的形态围绕在钯原子中心上,钯原子与P原子成4个单键,杂化轨道数为4,为sp3杂化,水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶,所以四(三苯基膦)钯分子在水中难溶,物质A中甲基上的C采取sp3杂化类型,C≡N为SP杂化,碳碳双键为sp2杂化,连接4个不同原子或原子团的碳原子为手性碳原子,如图: ,所以一个A分子中手性碳原子数目为3个,故答案为sp3;不易溶于水,水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶;sp、sp2、sp3;3;
,所以一个A分子中手性碳原子数目为3个,故答案为sp3;不易溶于水,水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶;sp、sp2、sp3;3;
(3)配位键由含有孤电子对的原子指向含有空轨道的原子,Pd含有空轨道、P原子含有孤电子对,所以配位键由P原子指向Pd原子,如图: 故答案为
故答案为 ;
;
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6-,即发生反应为:2PCl5=PCl4++PCl6-,PCl3中价层电子对个数=σ键个数+孤电子对个数=3+![]() (53×1)=4,所以原子杂化方式是sp3,PCl5中价层电子对个数=σ键个数+孤电子对个数=5+
(53×1)=4,所以原子杂化方式是sp3,PCl5中价层电子对个数=σ键个数+孤电子对个数=5+![]() (55×1)=4,所以原子杂化方式是sp3,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对.孤电子对对成键电子的排斥力大于成键电子对间的排斥力,所以PCl5中正四面体形阳离子中键角小于PCl3的键角,晶胞中PCl5位于顶点8×
(55×1)=4,所以原子杂化方式是sp3,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对.孤电子对对成键电子的排斥力大于成键电子对间的排斥力,所以PCl5中正四面体形阳离子中键角小于PCl3的键角,晶胞中PCl5位于顶点8×![]() =1,1个PCl5分子位于晶胞内部,立方体的晶胞边长为a pm,所以密度为:ρ=
=1,1个PCl5分子位于晶胞内部,立方体的晶胞边长为a pm,所以密度为:ρ=![]() =
=![]() ;
;
故答案为:PCl4+和PCl6-;两分子中P原子杂化方式均为sp3杂化,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,孤电子对对成键电子的排斥力大于成键电子对间的排斥力;![]() ;
;
(5)PBr5气态分子的结构与PCl5相似,说明PBr5也能电离出能导电的阴阳离子,而产物中只存在一种P-Br键长,所以发生这样电离PBr5═PBr4++Br-;
故答案为PBr5=PBr4++Br-。
【点晴】
本题考查物质结构和性质,涉及电子排布图、杂化方式的判断、电离方式和微粒结构等,侧重于基础知识的综合应用的考查,题目难度较大。杂化类型的判断方法:1)例如常见的简单分子,C2H2、CO2为直线型分子,键角为180°,推断其C原子的杂化轨道类型为sp;C2H4、C6H6为平面型分子,键角为120°,推断其C原子的杂化轨道类型为sp2;CH4、CCl4为正四面体,键角109.5°,推断其C原子的杂化轨道类型为sp3。扩展到以共价键形成的晶体,如:已知金刚石中的碳原子、晶体硅和石英中的硅原子,都是以正四面体结构形成共价键的,所以也都是采用sp3杂化;已知石墨的二维结构平面内,每个碳原子与其它三个碳原子结合,形成六元环层,键角为120°,由此判断石墨的碳原子采用sp2杂化。2)根据价层电子对互斥理论判断杂化类型:中心原子电子对计算公式:价电子对数n=![]() (中心原子的价电子数+配位原子的价电子数×m±电荷数)。注意:①当上述公式中电荷数为正值时取“-”,电荷数为负值时取“+”;②当配位原子为氧原子或硫原子时,成键电子数为零;根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化;3)对于有机物利用杂化轨道数=孤对电子对数+σ键数进行判断.如C2H2分子中碳原子形成1个C-H,1个C≡C(含1个σ键),C原子杂化轨道数为1+1=2,采取sp杂化方式,C2H4分子中碳原子形成2个C-H,1个C═C双键(含1个σ键),C原子杂化轨道数为(2+1)=3,C原子采取sp2杂化方式。
(中心原子的价电子数+配位原子的价电子数×m±电荷数)。注意:①当上述公式中电荷数为正值时取“-”,电荷数为负值时取“+”;②当配位原子为氧原子或硫原子时,成键电子数为零;根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化;3)对于有机物利用杂化轨道数=孤对电子对数+σ键数进行判断.如C2H2分子中碳原子形成1个C-H,1个C≡C(含1个σ键),C原子杂化轨道数为1+1=2,采取sp杂化方式,C2H4分子中碳原子形成2个C-H,1个C═C双键(含1个σ键),C原子杂化轨道数为(2+1)=3,C原子采取sp2杂化方式。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c