题目内容
向酯化反应:CH3COOH+C2H5OH
CH3COOC2H5+H2O的平衡体系中加
O,过一段时间,18O原子存在于( )
| 浓H2SO4 |
| △ |
| H2 | 18 |
| A、只存在于乙醇分子中 |
| B、存在于乙酸和H2O分子中 |
| C、只存在于乙酸乙酯中 |
| D、存在于乙醇和乙酸乙酯分子中 |
考点:聚合反应与酯化反应
专题:有机反应
分析:乙酸与乙醇的酯化反应为可逆反应,反应中乙酸脱去羟基、乙醇脱去氢原子,所以水中的氧原子来自乙酸,若在平衡体系中进入加
O,水中的18O会进入乙酸中,即含有18O的物质为乙酸和水,据此进行解答.
| H2 | 18 |
解答:
解:根据酯化反应原理可知,乙醇脱去羟基中的H原子、乙酸脱去羟基,所以水中的O来自乙酸,故在平衡体系中进入加
O,水中的18O会进入乙酸中,即含有18O的物质为乙酸和水,而乙醇和乙酸乙酯中不会含有18O原子,
故选B.
| H2 | 18 |
故选B.
点评:本题考查了酯化反应原理、可逆反应特点,题目难度中等,注意掌握酯化反应原理-“酸脱羟基醇脱氢”,明确酯化反应为可逆反应,水中的氧原子来自乙酸.

练习册系列答案
相关题目
下列有关方程式书写正确的是( )
| A、NaHCO3在水溶液中的电离:NaHCO3?Na++H++CO32- |
| B、水溶液中HS一发生水解:HS-+H2O?H3O++S2- |
| C、氢氧燃料电池碱性介质中正极反应式:O2+2H2O+4e-=4OH- |
| D、磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O |
C60的发现导致了一门新兴学科--碳球化学的兴起.C60与金属钾作用得到一种物质K3C60,其在低温下具有超导性能.则下列相关说法中,不正确的是( )
| A、在C60和K3C60中,碳元素分别以游离态和化合态存在 |
| B、C60是一种含碳化合物 |
| C、等质量的C60和金刚石含碳原子数目相同 |
| D、C60与石墨互为同素异形体 |
若在能溶解氧化铝的溶液中,分别加入下列各组离子,可能大量共存的是( )
| A、NH4+、NO3-、CO32-、Na+ |
| B、NO3-、Ca2+、K+、Cl- |
| C、Al3+、Ba2+、Mg2+、HCO3- |
| D、NO3-、K+、SO32-、H+ |
氧化还原反应在生产、生活中具有广泛的用途.下列生产、生活中的事例不包含氧化还原反应的是( )
| A、金属冶炼 | B、点制豆腐 |
| C、食物腐败 | D、燃放鞭炮 |
下列反应的化学方程式正确的是( )
A、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
| ||||
| B、在苯酚钠溶液中通入二氧化碳气体 2C6H5O-+CO2+H2O→2C6H5OH+CO32- | ||||
C、等物质的量浓度的ZnBr2和CuCl2混合溶液用惰性电极电解,最初发生:Cu2++2Br-
| ||||
D、甲醇的燃烧热的热化学方程式:CH3OH(l)+
|
实现下列变化,必需加入还原剂的是( )
| A、Cl2→HClO |
| B、Fe→FeCl3 |
| C、NaI→AgI |
| D、F2→HF |
下列离子方程式书写正确的是( )
| A、铁与稀硫酸反应 Fe+2H+=Fe3++H2↑ |
| B、氢氧化铝与足量盐酸反应 Al(OH)3+3H+=Al3++3H2O |
| C、钠和冷水反应 Na+2H2O=Na++H2↑+OH- |
| D、铜片与稀硝酸反应 Cu+NO3-+4H+=Cu2++NO↑+2H2O |
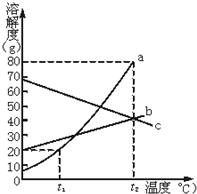 根据溶解度曲线回答问题.
根据溶解度曲线回答问题.