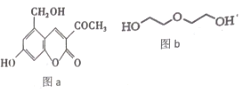
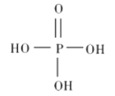
题目内容
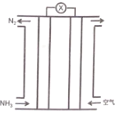
【题目】氨气与氧气构成的碱性燃料电池原理如图所示,下列说法正确的是
A.电解质溶液中电子移向正极
B.电池负极反应为:2NH3-6e-=N2+6H+
C.正负极通入的气体在相同条件下体积之比为15: 4 (假设空气中O2体积分数为20%)
D.该电池给铅蓄电池充电,燃料电池正极反应l molO2,铅蓄电池有2mol PbSO4被消耗
【答案】C
【解析】
该电池为燃料电池,通入氧气的一端为正极,通入氨气的一端为负极,根据图示,电池总反应为4NH3+3O2=2N2+6H2O。
A.电子只能在导体中转移,不能在溶液中转移,故A错误;
B.氨气与氧气构成的碱性燃料电池,不可能产生氢离子,电池负极反应为: 2NH3-6e-+6OH-=N2+6H2O,故B错误;
C.根据分析,投入空气的一端为正极,通入氨气的一端为负极,相同条件下,气体体积之比等于物质的量之比,电池总反应为4NH3+3O2=2N2+6H2O,当负极通入4mol氨气时,正极消耗3mol氧气,则需要空气的量为![]() =15mol,则正负极通入的气体在相同条件下体积之比为15 : 4,故C正确;
=15mol,则正负极通入的气体在相同条件下体积之比为15 : 4,故C正确;
D.该电池给铅蓄电池充电,燃料电池正极反应l molO2,转移4mol电子,充电时铅蓄电池阴极反应为:PbSO4+2e-=Pb+SO42-,阳极反应为:PbSO4-2e-+2H2O=PbO2+4H++SO42-,铅蓄电池两极都消耗PbSO4,转移4mol电子时,铅蓄电池共消耗了4mol PbSO4,故D错误;
答案选C。

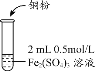
【题目】某化学兴趣小组利用硫酸铁溶液与铜粉反应,又向反应后溶液中加入KSCN溶液以检验Fe3+是否有剩余,实验记录如下;
实验编号 | 操作 | 现象 |
实验1 |
| i.加入Cu粉后充分振荡,溶液逐渐变蓝; ii.取少量i中清液于试管中,滴加2滴 0.2mol/LKSCN溶液,溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。 |
(1)写出实验1中第i步的离子方程式_______________。甲同学猜想第ii步出现的异常现象是由于溶液中的Cu2+干扰了检验Fe3+的现象。查阅相关资料如下
①2Cu2++4SCN- ![]() 2CuSCN↓(白色)+(SCN)2(黄色)
2CuSCN↓(白色)+(SCN)2(黄色)
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
该同学又通过如下实验验证猜想
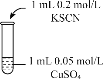
实验编号 | 操作 | 现象 |
实验2 |
| 溶液呈绿色,一段时间后后开始出现白色沉淀,上层溶液变为黄色 |
实验3 |
| 无色溶液立即变红,同时生成白色沉淀。 |
(2)经检测,实验2反应后的溶液pH值减小,可能的原因是___________________________________________。
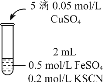
(3)根据实验2、3的实验现象,甲同学推断实验3中溶液变红是由于Fe2+被(SCN)2氧化,写出溶液变红的离子方程式_______________________。继续将实验2中的浊液进一步处理,验证了这一结论的可能性。

补充实验4的目的是排除了溶液存在Cu2+的可能,对应的现象是____________________________________________。
(4)乙同学同时认为,根据氧化还原反应原理,在此条件下,Cu2+也能氧化Fe2+,他的判断依据是_______。
(5)为排除干扰,小组同学重新设计如下装置。
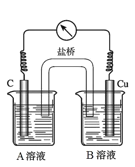
①A溶液为____________________________。
②“电流表指针偏转,说明Cu与Fe3+发生了反应”,你认为这种说法是否合理?__________________(填合理或不合理),原因是__________________________________________。
③验证Fe3+是否参与反应的操作是________________________________________