题目内容
 实验是化学的最高法庭.以镁条、铝片为电极,以NaOH稀溶液为电解质溶液构成原电池,人们普遍认为铝是负极. 某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
实验是化学的最高法庭.以镁条、铝片为电极,以NaOH稀溶液为电解质溶液构成原电池,人们普遍认为铝是负极. 某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:如图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/L NaOH溶液的烧杯中.开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生.根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是
(2)随后阶段,铝片发生的电极反应式
(3)铝表面的氧化膜用砂纸不易除去,而此实验中无需刻意除去,原因是
(4)若此实验中的电解质溶液改为稀硫酸,则电池的负极为
考点:电解原理
专题:电化学专题
分析:(1)开始阶段,原电池的正极是Al片;铝片表面产生的气泡是H2,负极是镁;
(2)随后阶段,负极是铝,正极是镁,电极反应式:O2+2H2O+4e-=4OH-;
(3)三氧化二铝能与氢氧化钠反应;
(4)电解质溶液改为稀硫酸后,和镁铝构成原电池.
(2)随后阶段,负极是铝,正极是镁,电极反应式:O2+2H2O+4e-=4OH-;
(3)三氧化二铝能与氢氧化钠反应;
(4)电解质溶液改为稀硫酸后,和镁铝构成原电池.
解答:
解:(1)开始阶段,原电池的正极是Al片;铝片表面产生的气泡是H2,负极是镁,电极反应式:Mg+2OH--2e-=Mg(OH)2,
故答案为:Al;H2;Mg+2OH--2e-=Mg(OH)2 ;
(2)随后阶段,负极是铝,电极反应式:Al+4OH--3e-=AlO2-+2H2O,正极是镁,电极反应式:O2+2H2O+4e-=4OH-;铝片中含有杂质构成原电池,放出气体,
故答案为:Al+4OH--3e-=AlO2-+2H2O;O2+2H2O+4e-=4OH-; 铝片中含有杂质构成原电池;
(3)三氧化二铝能与氢氧化钠反应:Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(4)电解质溶液改为稀硫酸后,和镁铝构成原电池,镁做负极,电极反应式为Mg-2e-=Mg2+,故答案为:Mg;Mg-2e-=Mg2+.
故答案为:Al;H2;Mg+2OH--2e-=Mg(OH)2 ;
(2)随后阶段,负极是铝,电极反应式:Al+4OH--3e-=AlO2-+2H2O,正极是镁,电极反应式:O2+2H2O+4e-=4OH-;铝片中含有杂质构成原电池,放出气体,
故答案为:Al+4OH--3e-=AlO2-+2H2O;O2+2H2O+4e-=4OH-; 铝片中含有杂质构成原电池;
(3)三氧化二铝能与氢氧化钠反应:Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(4)电解质溶液改为稀硫酸后,和镁铝构成原电池,镁做负极,电极反应式为Mg-2e-=Mg2+,故答案为:Mg;Mg-2e-=Mg2+.
点评:本题考查了原电池原理,难度不大,正确判断原电池正负极是解本题关键,注意:不能根据金属的活泼性强弱判断正负极,要根据具体的反应来判断,为易错点.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、绿色食品是不含任何化学物质的食品 |
| B、推广使用太阳能、风能、海洋能、氢能,不利于缓解温室效应 |
| C、在含硫的燃料中加入适量生石灰,可以减少二氧化硫的排放量 |
| D、含磷合成洗涤剂易于被细菌分解,故不会导致水体污染 |
 在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:
在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:
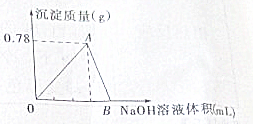 向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:
向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:
 某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):
某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):