题目内容
(1)研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是 (填序号)
A.铁片置于硫酸铜溶液中有铜析出;
B.铁、铜与氯气反应分别生成FeCl3、CuCl2;
C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+CuCl2)
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解
(2)请你另设计一个能证明铁的金属活动性比铜强的实验.要求:
a.此方案的原理不同于上述任一合理方案;
b.绘出实验装置图并注明所需的药品;
c.写出实验过程中的主要实验现象.
A.铁片置于硫酸铜溶液中有铜析出;
B.铁、铜与氯气反应分别生成FeCl3、CuCl2;
C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+CuCl2)
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解
(2)请你另设计一个能证明铁的金属活动性比铜强的实验.要求:
a.此方案的原理不同于上述任一合理方案;
b.绘出实验装置图并注明所需的药品;
c.写出实验过程中的主要实验现象.
| 实验装置 | 实验现象 | 实验结论 |
考点:金属在元素周期表中的位置及其性质递变的规律
专题:实验设计题
分析:(1)根据金属的活泼性顺序表可以确定金属性的强弱;
(2)除了金属活动顺序表外,原电池装置也可以证明两电极材料的金属性强弱.
(2)除了金属活动顺序表外,原电池装置也可以证明两电极材料的金属性强弱.
解答:
解:(1)A.铁片置于硫酸铜溶液中有铜析出,说明金属铁的活泼性强于铜,能证明铁的金属性比铜强,故A正确;
B.铁、铜与氯气反应分别生成FeCl3、CuCl2,证明氯气是氧化性强的物质,能将金属氧化为高价,不能说明铁的金属性比铜强,故B错误;
C.铜片置于FeCl3溶液中,铜片逐渐溶解:2FeCl3+Cu=2FeCl2+CuCl2,说明还原性是铜单质强于亚铁离子,不能说明铁的金属性比铜强,故C错误;
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡,证明金属铁能和硫酸之间发生置换反应,但是铜不能,所以能证明铁的金属性比铜强,故D正确;
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片会钝化,不溶解,而铜片则不会产生钝化现象,会溶解,不能说明铁的金属性比铜强,故E错误.
故选AD;
(2)除了金属活动顺序表外,在原电池中,如果两电极材料都是金属,负极金属的活泼性一般是强于正极金属的活泼性的,如Cu、Fe、硫酸原电池中金属铁是负极,金属铜是正极,能证明铁的金属性强于铜,故答案为:
B.铁、铜与氯气反应分别生成FeCl3、CuCl2,证明氯气是氧化性强的物质,能将金属氧化为高价,不能说明铁的金属性比铜强,故B错误;
C.铜片置于FeCl3溶液中,铜片逐渐溶解:2FeCl3+Cu=2FeCl2+CuCl2,说明还原性是铜单质强于亚铁离子,不能说明铁的金属性比铜强,故C错误;
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡,证明金属铁能和硫酸之间发生置换反应,但是铜不能,所以能证明铁的金属性比铜强,故D正确;
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片会钝化,不溶解,而铜片则不会产生钝化现象,会溶解,不能说明铁的金属性比铜强,故E错误.
故选AD;
(2)除了金属活动顺序表外,在原电池中,如果两电极材料都是金属,负极金属的活泼性一般是强于正极金属的活泼性的,如Cu、Fe、硫酸原电池中金属铁是负极,金属铜是正极,能证明铁的金属性强于铜,故答案为:
| 实验装置 | 实验现象 | 实验结论 |
 |
Fe:溶解 Cu:产生气泡 |
铁的金属性比铜强 |
点评:本题是一道关于金属性强弱的实验方案设计题,注意金属活动顺序表的应用以及原电池工作原理的应用是关键,难度不大.

练习册系列答案
相关题目
萃取碘水中的碘,可用的萃取剂是 ①四氯化碳 ②酒精 ③苯( )
| A、只有① | B、①和③ |
| C、①和② | D、①②③ |
以下原子轨道符号不正确的是( )
| A、1s | B、3d | C、2f | D、2p |
 为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2 溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:
为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2 溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作: A、B、C和铜关系如图:
A、B、C和铜关系如图: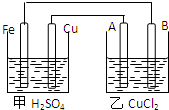 据图回答以下问题:
据图回答以下问题: