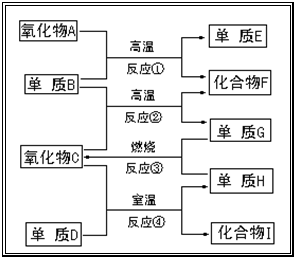
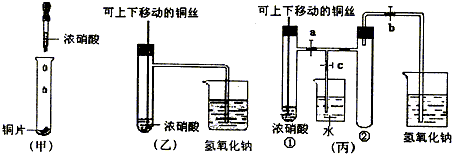
题目内容
3.下列元素中,原子半径最大的是( )| A. | Na | B. | Mg | C. | Al | D. | Si |
分析 同周期元素自左而右原子半径减小,同主族自上而下原子半径增大,据此判断.
解答 解:Na、Mg、Al、Si四种元素属于同周期元素,同周期元素自左而右原子半径减小,故原子半径Na>Mg>Al>Si,所以Na的原子半径最大,故A正确;
故选A.
点评 本题考查半径比较规律,题目难度较小,注意掌握微粒半径比较规律,侧重于考查学生对基本规律的掌握和应用能力.

练习册系列答案
相关题目
13.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.
(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.资料显示:SCN-的电子式为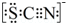 .
.
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
④若SCN-与Cl2反应生成1mol CO2,写出反应离子方程式SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,并计算转移电子的物质的量是16mol.
| 操 作 | 现 象 |
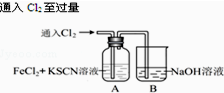 | I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.资料显示:SCN-的电子式为
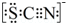 .
.①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
④若SCN-与Cl2反应生成1mol CO2,写出反应离子方程式SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,并计算转移电子的物质的量是16mol.
14.下列能与文字表述对应且正确的反应方程式是( )
| A. | 甲烷和氯气在光照条件下反应:2CH4+Cl2$\stackrel{光照}{→}$2CH3 Cl+H2 | |
| B. | 实验室用电石制乙炔:CaC2+2H2O→Ca(OH)2+HC≡CH↑ | |
| C. | 用NaOH溶液中和苯酚溶液的酸性:H++OH-═H2O | |
| D. | 向苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2 C6H5OH+CO32- |
11.下列物质中,属于天然高分子化合物的是( )
| A. | 硝化纤维 | B. | 硬脂酸 | C. | 淀粉 | D. | 聚乙烯 |
8.某元素位于周期表中的ⅣA族,它是良好的半导体材料,其金属性比非金属性强,所以通常认为它是金属元素.此元素可能是( )
| A. | Si | B. | Ge | C. | Sn | D. | Pb |
12.下列关于胶体的性质与应用的说法不正确的是( )
| A. | 静电除尘器除去空气或工厂废气中的飘尘是利用胶体粒子的带电性而加以除去 | |
| B. | 医学上的血液透析原理与胶体的渗析类似,透析膜与半透膜类似 | |
| C. | 从颜色上无法区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 由于胶休粒子之间的排斥作用,胶体粒子不易聚集成大的颗粒,所以胶体的性质相对比较稳定 |