题目内容
18.下列物质既属于钠盐又属于硫酸盐的是( )| A. | 碳酸钾 | B. | 硫酸钾 | C. | 碳酸钠 | D. | 硫酸钠 |
分析 盐是指含有金属离子(铵根)和酸根离子的化合物,可根据所含有的金属或酸根去命名,钠盐指由钠离子和酸根离子构成的盐,硫酸盐指金属离子(铵根)和硫酸酸根离子构成的盐,据此解答.
解答 解:A.含有钾离子和碳酸根离子,属于碳酸盐、钾盐,故A不选;
B.硫酸钾含有硫酸根离子和钾离子,属于硫酸盐、钾盐,故B不选;
C.碳酸钠含有碳酸根离子和钠离子,属于碳酸盐、钠盐,故C不选;
D.硫酸钠含有硫酸根离子和钠离子,属于硫酸盐、钠盐,故D选;
故选:D.
点评 本题主要考查了盐的分类,正确理解盐的定义、盐的分类依据是解题关键,题目难度不大.

练习册系列答案
相关题目
6.下列变化过程中表示的能量转化关系错误的是( )
| A. | 金属镁燃烧:化学能→热能和光能 | B. | 原电池:化学能→电能 | ||
| C. | 植物的光合作用:太阳能→热能 | D. | 太阳能热水器:光能→热能 |
13.飞船内安装盛有Na2O2的装置,它的用途是产生氧气.下列关于Na2O2的叙述正确的是( )
| A. | Na2O2中阴、阳离子的个数比为1:1 | |
| B. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 | |
| C. | Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等 | |
| D. | Na2O2的漂白原理与SO2的漂白原理相同 |
3.下列性质的比较中,正确的是( )
| A. | 氧化性:S>Cl2 | B. | 金属性:K<Na | ||
| C. | 热稳定性:NaHCO3>Na2CO3 | D. | 酸性:HClO4>H2SO4 |
10.在氧化钕(Nd2O3)等稀土催化剂的作用下可发生反应:4CO+2NO2═N2+4CO2,若该反应的反应速率分别用v(CO)、v(NO2)、v(N2)、v(CO2)表示,则下列关系正确的是( )
| A. | $\frac{1}{2}$v(CO)=v(NO2) | B. | $\frac{1}{2}$v(NO2)=v(CO2) | C. | $\frac{1}{4}$v(N2)=v(CO2) | D. | $\frac{1}{4}$v(N2)=v(CO) |
7.化学方程式可简明地体现元素及其化合物的性质.已知:
氧化还原反应:
2FeCl3+2HI═2FeCl2+I2+2HCl;
2Co(OH)3+6HCl═2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH═2Fe(OH)3+2KI;
3I2+6KOH═5KI+KIO3+3H2O
复分解反应:
2HSCN+K2CO3═2KSCN+CO2↑+H2O;
KCN+CO2+H2O═HCN+KHCO3
热分解反应:4NaClO$\frac{\underline{\;\;△\;\;}}{\;}$3NaCl+NaClO4;NaClO4$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+2O2↑
下列说法不正确是:( )
氧化还原反应:
2FeCl3+2HI═2FeCl2+I2+2HCl;
2Co(OH)3+6HCl═2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH═2Fe(OH)3+2KI;
3I2+6KOH═5KI+KIO3+3H2O
复分解反应:
2HSCN+K2CO3═2KSCN+CO2↑+H2O;
KCN+CO2+H2O═HCN+KHCO3
热分解反应:4NaClO$\frac{\underline{\;\;△\;\;}}{\;}$3NaCl+NaClO4;NaClO4$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+2O2↑
下列说法不正确是:( )
| A. | 酸性(吸水溶液):HSCN>H2CO3>HCN | B. | 还原性(碱性溶液):Fe(OH)2>I->KIO3 | ||
| C. | 热稳定性:NaCl>NaClO4>NaClO | D. | 氧化性(酸性溶液):I2>FeCl3>Co(OH)3 |
8.一定条件下,4mol A气体和2mol B气体在2L的密闭容器中发生反应:2A(g)+B(g)?3C(g),经2s后测得C的浓度为0.9mol•L-1,下列说法正确的是( )
| A. | 2s末A和B的转化率相同 | |
| B. | 2s末A的浓度为0.6mol/L | |
| C. | 反应速率$\frac{{v}_{(A)}}{{v}_{(B)}}$=$\frac{1}{2}$ | |
| D. | 用B表示的平均反应速率为0.3mol/(L•s) |
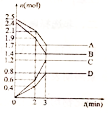 在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间 t(min)的变化曲线如图所示,回答下列问题:
在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间 t(min)的变化曲线如图所示,回答下列问题:
 ;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为开始生成蓝色沉淀,后蓝色沉淀溶解,得到深蓝色的透明溶液.
;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为开始生成蓝色沉淀,后蓝色沉淀溶解,得到深蓝色的透明溶液.