题目内容
用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、0.1mol?L-1稀硫酸100mL中含有硫酸根离子个数为0.1NA |
| B、常温常压下,氧气和臭氧的混合物16g中含有NA个氧原子 |
| C、7.8 g Na2O2含有的阴离子数目为0.2 NA |
| D、NO2与足量的水完全反应,若有1molNO生成,则转移电子数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.依据n=C×V计算出硫酸的物质的量,硫酸为强电解质,1个硫酸分子电离产生1个硫酸根离子解答;
B.氧气和臭氧都是有O原子构成,依据n(O)=
计算解答;
C.1个过氧化钠中含有2个钠离子和1个过氧根离子;
D.依据方程式:3NO2+H2O=2HNO3+NO 结合反应中N元素化合价变化解答.
B.氧气和臭氧都是有O原子构成,依据n(O)=
| m(O) |
| M(O) |
C.1个过氧化钠中含有2个钠离子和1个过氧根离子;
D.依据方程式:3NO2+H2O=2HNO3+NO 结合反应中N元素化合价变化解答.
解答:
解:A.0.1mol?L-1稀硫酸100mL含硫酸的物质的量为0.1mol?L-1×0.1L=0.01mol,1个硫酸分子电离产生1个硫酸根离子,所含硫酸根离子的个数为0.01mol×NA=0.01NA,故A错误;
B.16g氧气和臭氧的混合物所含O个数为:
×NA=NA,故B正确;
C.7.8 g Na2O2的物质的量为
=0.1mol,含阴离子的个数为:0.1mol×1×NA=0.1NA,故C错误;
D.3NO2+H2O=2HNO3+NO,其中2分子NO2中的氮原子失电子,化合价由+4价升高到+5价,共失去2×e-,1分子NO2中的氮原子得电子,化合价由+4价降低到+2价,得2e-,所以生成1molNO时转移电子数2NA,故D错误;
故选:B.
B.16g氧气和臭氧的混合物所含O个数为:
| 16g |
| 16g/mol |
C.7.8 g Na2O2的物质的量为
| 7.8g |
| 78g/mol |
D.3NO2+H2O=2HNO3+NO,其中2分子NO2中的氮原子失电子,化合价由+4价升高到+5价,共失去2×e-,1分子NO2中的氮原子得电子,化合价由+4价降低到+2价,得2e-,所以生成1molNO时转移电子数2NA,故D错误;
故选:B.
点评:本题考查阿伏加德罗常数的应用,题目难度不大,明确物质的量、粒子数、质量、体积等与阿伏加德罗常数关系,掌握氧化还原反应分析方法是解题关键.

练习册系列答案
相关题目
下列说法正确的是( )
| A、2mol的盐酸 |
| B、0.1mol氢 |
| C、0.3molHCl |
| D、4mol的氧元素 |
天然气根据成分不同分为贫气和富气,贫气中甲烷的含量较多,富气中乙烷、丙烷、丁烷的含量相对高一些.若要将它们液化,下列说法正确的是( )
| A、贫气易液化 |
| B、富气易液化 |
| C、二者液化条件相同 |
| D、加压降温均有利于两者液化 |
已知有如下反应:Cl2+2I-=2Cl-+I2;Cl2+2Fe2+=2Cl-+2Fe3+;2Fe3++2I-=I2+2Fe2+;I2+SO2+2H2O=2I-+SO42-+4H+,下列叙述正确的是( )
| A、该反应是不可能发生的:Cl2+SO2+2H2O=2Cl-+SO42-+4H+ |
| B、氧化性:Cl2>Fe3+>I2 |
| C、还原性:I->Cl->Fe2+ |
| D、将SO2通入FeCl3溶液中得不到 SO42- |
设NA表示阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,5.6L氧气含有n个O2,则NA为4n |
| B、常温常压下,1mol氦气含有的原子数为2NA |
| C、常温下,1mol氧气和足量氢气反应,转移的电子数为2NA |
| D、18克水中所含的电子数为8NA |
已知25℃时几种弱酸的电离平衡常数:
则下列有关说法正确的是( )
| 弱酸 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.7×10-8 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A、相同浓度的CH3COONa和NaClO的混合溶液中:C(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
| B、pH相等的CH3COONa、NaClO和Na2CO3溶液:c(NaClO)<c(CH3COONa)<c(Na2CO3) |
| C、amol/L HClO溶液与bmol/L NaOH溶液等体积混合后,所得溶液中:c(Na+)>c(ClO-),则b一定大于a |
| D、向0.1mol/L CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液的pH=5 |
 曾引起台湾地区食品安全轩然大波的塑化剂的分子结构如图所示:下列叙述中不正确的是( )
曾引起台湾地区食品安全轩然大波的塑化剂的分子结构如图所示:下列叙述中不正确的是( )| A、该物质的分子式为C24H38O4 |
| B、该物质属于酯类,不溶于水 |
| C、该物质能与溴水发生加成反应 |
| D、该物质发生水解反应,其生成的醇只有一种 |
 某课外活动小组准备用如图所示的装置进行实验,现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液
某课外活动小组准备用如图所示的装置进行实验,现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液| A电极 | B电极 | X溶液 | |
| 甲 | Cu | Zn | H2SO4 |
| 乙 | Pt | Pt | CuCl2 |
| 丙 | Fe | Cu | ? |
| A、甲同学在实验中将开关K5闭合,Zn电极上产生气泡 |
| B、乙同学打算闭合K3、K4做电解CuCl2溶液的实验 |
| C、乙同学用淀粉碘化钾试纸检验电解产生的氯气 |
| D、丙同学准备在Fe上镀Cu,选择了一种铜盐来配制电镀液,闭合的开关的组合是K2、K3 |
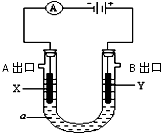 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板(X、Y都是惰性电极),A、B 是出口,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板(X、Y都是惰性电极),A、B 是出口,通过导线与直流电源相连.请回答以下问题: