题目内容
【题目】I、为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
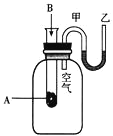
(1)该反应为________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量_________(填“高”或“低”)。
(3)该反应的物质中的化学能通过化学反应转化成________释放出来。
(4)该反应的反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)Ⅱ、同素异形体相互转化的反应热相当小,而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成还是分几步完成,这个总过程的热效应是相同的”观点来计算反应热。
已知:
①P4(白磷,s)+5O2(g)= P4O10(s) ΔH=-2983.2 kJ·mol1
②P(红磷,s)+5/4O2(g)=1/4P4O10(s) ΔH=-738.5 kJ·mol1
则白磷转化为红磷的热化学方程式为__________。相同状况下,能量状态较低的是________;白磷的稳定性比红磷_________(填“高”或“低”)。
【答案】放热 高 热能 低 P4(白磷,s)=4P(红磷,s) △H=-29.2kJ/mol 红磷 低
【解析】
Ⅰ.(1)因为发生反应A+B=C+D,U型管中甲处液面下降乙处液面上升,根据气体具有热胀冷缩的性质可以判断该反应为放热反应;
(2)因为反应为放热反应,所以A和B的总能量比C和D的总能量高;
(3)化学变化伴随着物质和能量变化,物质中的化学能通过化学反应转化成热能释放出来;
(4)化学反应中旧键断裂吸收能量,新键生成放出能量,该反应为吸热反应,则反应物化学键断裂吸收的能量低于生成物化学键形成放出的能量;
II. 根据盖斯定律①-②×4可得P4(白磷,s)=4P(红磷,s) △H=-29.2kJ/mol,说明白磷转化为红磷是放热反应,相同的状况下,能量比白磷低,因为能量越低物质越稳定,则白磷的稳定性比红磷低。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案