题目内容
14.下列叙述错误的是( )| A. | 在NH4Cl饱和溶液中加入金属镁可以得到两种气体 | |
| B. | pH=12Ba(OH)2溶液中c(OH-)是0.001mol/LNaOH溶液c(OH-)的10倍 | |
| C. | 常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) | |
| D. | 常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的4倍,已知:KSP[Cd(OH)2]=7.2×10-15,Ksp[Co(OH)2]=1.8×10-15 |
分析 A.铵根离子水解生,溶液显示酸性,镁与氢离子反应生成氢气,促进了铵根离子的水解,则会生成氨气;
B.温度影响溶液的pH,没有告诉在常温下,无法计算pH=12的氢氧化钡溶液中氢氧根离子浓度;
C.混合液为中性,则c(H+)=c(OH-),结合电荷守恒可得:c(Na+)=c(CH3COO-);
D.同一溶液中,氢氧根离子浓度相等,c(Cd2+)和c(Co2+)的浓度之比等于其溶度积之比.
解答 解:A.在NH4Cl饱和溶液中加入金属镁,镁与铵根离子水解生成的氢离子反应生成氢气,促进了铵根离子的水解,则同时会生成氨气,故A正确;
B.没有告诉温度,则pH=12Ba(OH)2溶液中的氢氧根离子浓度不一定为0.01mol/L,无法判断两溶液中的氢氧根离子浓度大小,故B错误;
C.常温下,CH3COONa和CH3COOH的混合溶液中(pH=7),则c(H+)=c(OH-),结合电荷守恒可得:c(Na+)=c(CH3COO-),则溶液中离子浓度大小为:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-),故C正确;
D.常温下,Cd(OH)2和Co(OH)2的混合悬浊液中氢氧根离子浓度相同,c(Cd2+)与c(Co2+)之比与其溶度积之比相等=$\frac{7.2×1{0}^{-15}}{1.8×1{0}^{-15}}$=4,故D正确;
故选B.
点评 本题考查了离子浓度大小比较、难溶物溶度积的计算、溶液pH的计算等知识,题目难度中等,注意掌握盐的水解原理及其应用,明确电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用,试题充分考查了学生的分析、理解能力.

练习册系列答案
相关题目
4.下列有关核外电子的运动状态的说法中错误的是( )
| A. | 电子亚层(能级)是描述电子运动的电子云状态 | |
| B. | 只有在电子层、电子亚层、电子云的伸展方向及电子的自旋都确定时,电子的运动状态才能确定下来 | |
| C. | 必须在B项所述四个方面都确定时,才能决定组成每一能层的最多轨道数 | |
| D. | 电子云伸展方向与能量大小是无关的 |
5.对下列电解质溶液的叙述错误的是( )
| A. | 等物质的量浓度的Na2 C O3和NaHCO3混合液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| B. | 25℃时 0.2 mol•L-1盐酸与等体积0.05 mol•L-1Ba(OH)2溶液混合后,溶液的pH=l | |
| C. | pH=3的二元弱酸H2R溶液与pH=ll的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)十c(HR-)=c(Na+) | |
| D. | 25℃时,若0.3 mol•L-1 HY溶液与0.3 mol.L-lNaOH溶液等体积混合后,溶液的 pH=9,则:c(OH-)-c(HY)-c(H+)=1×lO-9 mol•L-1 |
9.短周期元素X、Y、Z、W的原子序数依次增大,X-与Y2+电子层结构与Ne原子的电子层结构相同,Z单质是金属,W的最外层电子数是内层电子总数的一半,下列正确的是( )
| A. | 原子半径r(X)<r(Y),离子半径r(X-)>r(Y2+) | |
| B. | X的简单气态氢化物的稳定性比W的弱 | |
| C. | X分别与Y、W形成的化合物中化学键类型相同 | |
| D. | Z是活泼的金属,其最高价氧化物对应的水合物为强碱 |
19.实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间判断空气中的含汞量,其反应为:4CuI+Hg=Cu2Hgl4+2Cu2,下列说法正确的是( )
| A. | 产物Cu2HgI4中,Cu元素的化合价为+2 | |
| B. | 由Cu2+与I-直接反应制得CuI的离子方程式为Cu2++I-=CuI | |
| C. | 该反应的氧化剂CuI,氧化产物为Cu | |
| D. | 当有2molCuI参与反应时,转移电子为1mol |
6.下列气体除杂所用试剂错误的是(括号内为杂质)( )
| A. | Cl2(HCl):饱和食盐水 | B. | H2(H2S、HCl、H2O):碱石灰 | ||
| C. | SO2(HCl):Na2SO3溶液 | D. | CO2(H2S):CuSO4溶液 |
3.2015年2月,科学家首次观测到化学键的形成.化学键不存在于( )
| A. | 原子与原子之间 | B. | 分子与分子之间 | C. | 离子与离子之间 | D. | 离子与电子之间 |
4.下列有关六方最密堆积与面心立方最密堆积的说法中正确的是( )
| A. | 六方最密堆积是最密堆积,面心立方最密堆积不是最密堆积 | |
| B. | 两者都是最密堆积,其中六方最密堆积是一、三、五…各层球心重合,二、四、六…各层球心重合;面心立方最密堆积是四、五、六…层分别和一、二、三…球心重合 | |
| C. | 原子晶体一般都采用六方最密堆积或面心立方最密堆积 | |
| D. | 只有金属晶体才可能采用六方最密堆积或面心立方最密堆积 |

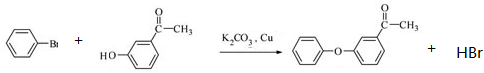 .
. 、
、 、
、 、
、 (其中一种).
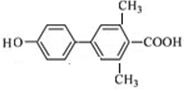
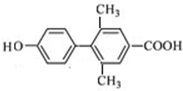
(其中一种).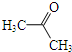 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: