题目内容
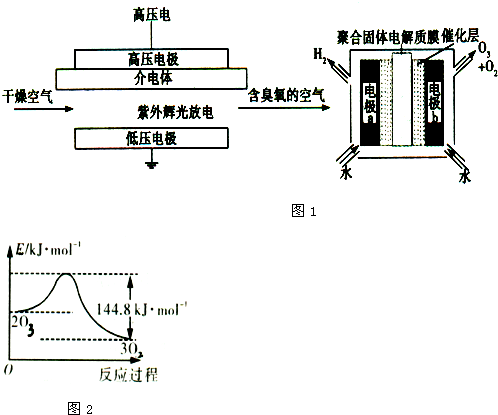
臭氧是重要的氧化剂和水处理剂.已知:2O3(g)?3O2(g)△H=-144.8kJ/mol,t℃时K=3×1076,下列说法错误的是( )
分析:A、依据反应特征和自发进行的判断依据△H-T△S<0分析判断;
B、t℃时3O2(g)?2O3(g)平衡常数是2O3(g)?3O2(g)平衡常数的倒数计算;
C、通电氧气变化为臭氧是电能转化为化学能
D、氧气和臭氧能量不同,碳燃烧过程中反应放出的热量不同.
B、t℃时3O2(g)?2O3(g)平衡常数是2O3(g)?3O2(g)平衡常数的倒数计算;
C、通电氧气变化为臭氧是电能转化为化学能
D、氧气和臭氧能量不同,碳燃烧过程中反应放出的热量不同.
解答:解:A、自发进行的判断依据△H-T△S<0,2O3(g)?3O2(g)△H=-144.8kJ/mol,反应△H<0,△S>0,所以任何温度下都有△H-T△S<0,反应自发进行,故A正确;
B、t℃时3O2(g)?2O3(g)平衡常数是2O3(g)?3O2(g)平衡常数的倒数,K=
3.33×10-77 ,故B正确;
C、通电氧气变化为臭氧是电能转化为化学能的过程,故C正确;
D、氧气和臭氧能量不同,依据能量守恒,1mol碳燃烧过程中反应放出的热量不同,故D错误;
故选D.
B、t℃时3O2(g)?2O3(g)平衡常数是2O3(g)?3O2(g)平衡常数的倒数,K=
| 1 |
| 3×1076 |
C、通电氧气变化为臭氧是电能转化为化学能的过程,故C正确;
D、氧气和臭氧能量不同,依据能量守恒,1mol碳燃烧过程中反应放出的热量不同,故D错误;
故选D.
点评:本题考查了反应自发进行的判断依据,平衡常数计算应用,盖斯定律的分析判断,题目难度中等.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目